
口腔颌面外科中的三叉神经损伤:文献综述
前言
目前口腔颌面外科医生和牙医开展了许多存在三叉神经损伤风险的手术。无论在诊所还是在医院,全面了解三叉神经损伤的病因和管理,对口腔外科医生更安全、更有效地开展相关手术至关重要。第三磨牙拔除是三叉神经损伤最常见的病因[1]。在下颌第三磨牙拔除手术中,下牙槽神经 (inferior alveolar nerve, IAN) 损伤的发生率约为4‰[1],舌神经损伤的发生率较低,约为1‰[1]。其中约25% 的患者在损伤后一年仍存在感觉障碍[2]。在拔除下颌第三磨牙前,手术医生有责任与患者就手术的风险进行充分的讨论,并且必须获得患者的知情同意。尽管有知情同意,但这些三叉神经损伤仍然是针对临床医生的重要诉讼来源[3]。
舌神经损伤给患者生活造成的影响更大,可能导致患者言语、味觉和咀嚼功能障碍[3]。舌神经有较大的解剖变异性,尸体研究表明,大约7%的标本中舌神经位于下颌第三磨牙舌侧牙槽嵴的上方[4],约26%的标本中舌神经与舌侧骨板直接接触 [4]。Miloro等采用MRI评估了10名健康志愿者的舌神经位置[5],发现舌神经与舌侧牙槽嵴的平均垂直距离为 2.75±0.97 mm,且10% 的神经位于舌侧牙槽嵴上方 [5];舌神经到舌侧骨板的平均水平距离为2.53±0.67 mm,25%的神经与舌侧骨板直接接触[5]。在第三磨牙拔除手术中,由于手术切口过于靠近舌侧软组织或不规范使用磨头去骨导致舌侧骨板穿孔,都可能会损伤舌神经。此外,在进行阻生齿的舌向脱位或舌侧切割牙时,舌神经损伤的发生率显著增加[6]。一项研究发现,垂直分牙比水平分牙更容易导致舌神经损伤,尽管这两种技术都有舌神经损伤风险 [6]。该研究同时发现,相比Freer骨膜分离器,Obwegeser骨膜分离器更容易损伤舌神经[6]。该研究未发现伤口缝合与舌神经损伤相关[6]。由于舌神经在常规术前影像检查中无法显示,手术过程中也无法知道其精确位置[7],因此手术医生在下颌舌侧软、硬组织附近进行操作时应格外小心[7]。
另一方面,下牙槽神经在全景片和CBCT上很容易识别,这有助于术者在手术前评估神经损伤的风险。阻生牙的深度与神经损伤的发生率直接相关,一些典型的影像学表现可以提示牙根与下牙槽神经非常接近[8],如牙根变暗和下牙槽神经管连续性丧失等[9]。术中如果发现手术部位大量出血和下牙槽神经暴露,均提示术后可能出现感觉异常[10]。在术前已确定下牙槽神经损伤风险较高的情况下,许多医生可能会考虑在拔牙时进行阻生齿部分拔除。该手术残留的根尖虽然可能会继发感染,但在智齿深度埋伏的情况下,采用此方法拔除智齿可以使下牙槽神经损伤的风险显著降低[11]。但必须告知患者,遗留的牙根可能会随时间发生位置改变,因此需要二期手术拔除遗留的牙根。
有文献报道阻滞或局部浸润麻醉可能导致下牙槽神经或舌神经支配区域的永久性感觉丧失。Pogrel发现,由于阻滞麻醉导致下牙槽神经损伤的发生率估计为1:26762到1:160571[12]。虽然这些病例中的大多数都会自行恢复,但有些可能会导致永久性感觉障碍。使用多次而变钝或带刺的针头在从口腔内软组织拔出时可能造成神经损伤,导致神经内血肿和随后的感觉异常[13]。局部麻醉剂注射也可能导致神经化学损伤,但由于神经外膜未破坏,这种情况发生概率较小[13]。目前仍需要进一步研究以明确局部麻醉药物注射后神经损伤的确切机制。
由于技术的进步和患者满意度的提高,骨内种植体的植入在过去几十年中显著增加。然而,如果在植入术中不熟悉解剖结构,导致下牙槽神经或颏神经支配区域感觉改变则属于医疗不良事件。例如,颏神经的前环在颏孔的影像边界前5mm[14]。此外,后牙缺失会导致下颌骨后牙区出现一定程度的垂直骨吸收,使该区域易发生医源性神经损伤。种植钻可能会直接损伤神经,另外手术造成的下颌神经管内出血、种植骨和周围结构的热损伤以及局部水肿等均会导致神经受压,进而引起患者感觉异常[15]。因此,骨内种植体与下颌神经管之间以2 mm为安全距离[16]。如果下颌骨严重萎缩,种植高度不足,改用短种植体(≤6 mm)是一种有效的替代方案,但是文献中尚缺乏长期随访结果[17]。也可以根据术前CBCT制定植入种植体方案,将种植体置于下牙槽神经的颊侧或舌侧。然而,这依赖于足够的下颌骨宽度以确保种植体能够安全植入。如果没有种植导板或导航系统的帮助,手术难度较大[18]。最后,也可以在种植术前进行下牙槽神经移位术,但是由于手术时对神经的牵拉等操作,该技术本身可能导致不同程度的永久感觉障碍[19]。虽然大多数患者在6个月内感觉恢复,但还是限制了下牙槽神经移位术的应用[19]。
牙髓治疗也可能导致下牙槽神经损伤。这种损伤通常是下颌磨牙根尖孔过度扩大,导致化学或机械刺激物直接进入下牙槽神经管[20](图1)。化学损伤可能导致神经纤维化;如果侵犯神经外膜,则可能发展为外生性神经瘤[21]。
在正颌手术中也可能发生下牙槽神经医源性损伤,但许多人认为这是正常术后反应,而不是手术并发症,因为受影响的神经分支与计划的截骨术密切相关。在进行双侧矢状劈开截骨术(bilateral sagittal split osteotomy, BSSO)时,由于下牙槽神经可能外露和游离,术后可能出现下牙槽神经暂时性感觉障碍[22]。手术中舌神经损伤风险较低,但下颌过度后退或放置贯穿舌皮质的长螺钉可能会导致舌神经暂时的感觉障碍[22]。颏成形术采用下颌前庭切口,在截骨术前需解剖并暴露双侧颏神经。解剖颏神经的过程中,或者截骨线过于靠近颏神经的前环,也可能会造成颏神经损伤[23]。颏成形术中的牵拉引起的神经感觉障碍大多数都会自行恢复[23]。类似地,在进行Le Fort I型截骨术时需暴露眶下神经,由于牵拉软组织而施加在该神经上的压力通常会引起患者术后上唇、脸颊、下眼睑和鼻侧的暂时性感觉减退[24]。
颞下颌关节(temporomandibular joint, TMJ)关节镜检查是一种罕见的三叉神经损伤原因,其中耳颞神经损伤的风险最大。多达23.4%的患者在术后出现该神经支配区域的暂时性感觉异常,这可能是由于术中冲洗关节腔时水压过大或液体外渗造成神经压迫引起的[25]。TMJ关节镜的严重并发症之一是内侧囊穿孔,导致液体外渗到翼下颌间隙,从而压迫下牙槽神经和舌神经,这种神经损伤通常也有自限性[25]。
口腔颌面创伤是口腔颌面外科医生遇到三叉神经损伤的最常见原因。下颌骨受到创伤时,下牙槽神经极易受损。如颏孔区骨折可能导致颏神经断裂,引起永久性感觉异常[26];同样,伴有移位的下颌体或下颌角骨折可能会造成下牙槽神经剪切或牵拉损伤[26];下颌骨枪伤具有高度破坏性,根据其发生位置,可能会造成下牙槽神经断裂,引起不可逆性损伤[27]。颧上颌复合体骨折往往累及眶下缘,骨折线通常延伸至眶下孔和眶下管,从而损伤眶下神经[28]。同理,眶上孔上方的额骨骨折可能损伤眶上神经[29]。
颌面部骨折的外科修复手术是另一种可能损伤三叉神经各分支的原因。例如,进行骨折段坚固内固定时,神经可能被钻头和螺钉刺伤[30];牵拉骨折段或解剖暴露骨折断端时也可能发生神经损伤[30]。因此,手术前需要对创伤患者进行完善的检查,对出现的所有感觉障碍都必须严格记录,以备后期的司法鉴定。在大多数情况下,骨折的复位和固定有利于减轻神经压迫[2]。单皮质螺钉固位技术可以避免穿透下牙槽神经管,继而减少潜在的感觉障碍并发症[2]。此外,在下颌下缘小心进行双皮质固位也可以预防医源性下牙槽神经损伤。
最后,造成局部骨质破坏的疾病也可引起三叉神经损伤,包括恶性肿瘤(即肉瘤、颌骨肿瘤和唾液腺病变)[31]。三叉神经多个分支的感觉异常是提示恶性肿瘤或神经退行性病变(如多发性硬化病)的隐匿特征[31]。脑血管意外引起的中枢皮质损伤也可能导致三叉神经感觉障碍[31]。相关参考文献见我们提交的叙述性审查报告清单(https://fomm.amegroups.com/article/view/10.21037/fomm-21-26/rc).
方法
三叉神经损伤的分类
我们进行了全面的文献综述,以确定最常用的神经损伤分类系统。此外,我们采用PubMed和MEDLINE等在线数据库研究了临床神经感觉测试方法和神经损伤的治疗方法。医学研究委员会量表(Medical Research Council Scale,MRCS)通常用于描述三叉神经损伤程度及其后续的恢复情况。基于感觉功能的临床评估,该量表包含8个不同的类别[32],从S0(未恢复)到S4(完全恢复)(MRCS量表的详细说明可参阅参考文献第44篇Bagheri等的文献)。使用MRCS系统,功能性感觉恢复(functional sensory recovery,FSR)被定义为S3或更高等级[32]。S3对应疼痛和触觉的恢复,无过敏反应,静态两点辨别距离小于15 mm[32]。其他用于评估感觉功能恢复的分类系统包括Seddon和Sunderland系统。这两个系统都是根据损伤的深度来表征神经损伤程度(即损伤是否累及神经外膜、神经束膜或神经内膜)[33]。Seddon分类系统将神经损伤分为三类,分别为神经麻痹、轴索断裂和神经断裂(按严重程度递增的顺序列出)[33]。Sunderland分类系统在此基础上增加了两类损伤,即损伤神经丛的程度[33]。
临床感觉神经测试
标准化的感觉神经测试方法对损伤的精确分类和临床症状改善的监测至关重要。标准的检查方法是:第一步,先用软毛刷检查面部感觉,绘制出面部感觉障碍范围;接下来,使用von Frey单丝检测静态触压觉,以评估A-β神经纤维[34-35]。检测方法为:将单丝垂直于检测区域的皮肤表面,逐渐加力直到单丝开始弯曲(图2A)[36],von Frey每个单丝上标注着可以使之弯曲的作用力大小[36]。检查者应提醒患者,若感受到脸上有轻微触感时,及时告知医生。最后记录下患者可感知的最小单丝规格。通常,正常的三叉神经可以感受到最小的两个单丝(1.65或2.36)[36]。
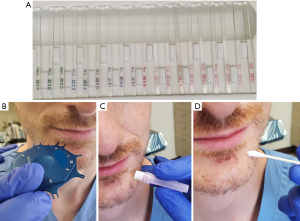
使用软刷或von Frey单丝还可对患者的方向辨别力进行检测,以评估较粗的有髓神经A-α纤维和A-β纤维的功能[36]。使用boley量规或其他类似装置来进行两点辨别测试可以评估A-δ纤维和无髓鞘C-纤维的功能(图2B)[36]。两点辨别测试从大距离开始,随后每次检测减少2 mm,直到患者无法再感受到2个点为止[36]。下牙槽神经的正常两点辨别距离为4~5 mm,舌神经的正常两点辨别距离为3~4 mm[36]。
针刺伤害感觉测试是用来评估少髓鞘的A-δ神经纤维和无髓鞘的C-纤维的游离神经末梢的感觉功能[34]。目前使用无菌牙科针头针刺面部感觉障碍区域,通过与正常侧对比来评估患侧的感觉敏感、迟钝或与正常侧相同(图2C)[36]。冷觉由无髓鞘的C纤维传导,可以将Endo-Ice(Coltene)喷于棉签上作为冷刺激源进行冷觉功能检测(图2D)[36]。热觉由A-δ纤维传导,可将棉签浸于热水中作为热刺激源进行热觉功能检测[36]。
讨论
三叉神经显微外科手术:适应证
三叉神经显微外科手术有特定的适应证,只有一小部分三叉神经损伤的患者最终会接受手术治疗。神经感觉障碍持续3个月以上且无法自行恢复的患者,才考虑手术治疗[37]。其他手术适应证包括:3个月时感觉障碍无明显改善或者症状加重[37];感觉严重减退,患者无法耐受也是手术的适应证[37];对于可见的神经断裂,如果不重新吻合神经断端,就无法实现FSR[37],这是急诊手术的适应证。磁共振神经成像可以显示断裂的神经[38]。三叉神经显微外科手术的禁忌证包括中枢神经病理性疼痛、感觉功能改善、患者耐受良好的感觉减退以及神经损伤时间过长[39]。此外,有严重基础疾病、无法进行全身麻醉的患者,也是手术的禁忌证[39]。
三叉神经显微外科手术:方法
三叉神经损伤的显微修复需在手术室进行。患者经鼻插管全身麻醉,使用开口器和压舌板清晰显示神经损伤侧的磨牙后区。对舌神经损伤的患者,在患侧第一前磨牙做龈缘切口,经第三磨牙区,一直延伸至下颌骨外斜嵴,全层翻起舌侧黏骨膜瓣,暴露下颌骨舌侧,将2-0丝线穿过舌侧黏骨膜瓣,向对侧牵开。然后使用Dierks牵开器置于舌侧黏骨膜下方,最终游离出断裂舌神经的近心端和远心端。
下牙槽神经损伤修复也可以采用上述方法,不同的是无需进行舌侧软组织的剥离和牵开。虚拟手术系统可用于设计术中截骨导板(图3A, 图3B)。使用计算机设计的手术导板可以限制去骨量,从而最大限度地减少并发症。一旦下颌骨外侧暴露,在生理盐水冲洗下使用圆形钨钢磨头去除覆盖在下颌神经管外的骨皮质(图3C, 图3D)。接近下牙槽神经管时,使用损伤较小的金刚球钻,以避免神经意外损伤。受损神经完全暴露后,可进行显微外科修复。三叉神经修复通常在神经外膜层完成,因为神经外膜修复和神经束膜修复效果没有明显差异[39]。选择直径为7-0或更小的无炎症反应材料(如尼龙)缝合线来缝合神经,可以减少术后瘢痕的形成[39]。必须在无张力条件下缝合神经外膜,如果无法进行一期无张力修复,则建议神经移植修复。或者使用神经支架导管进行修复,以将神经修复张力降至最低。
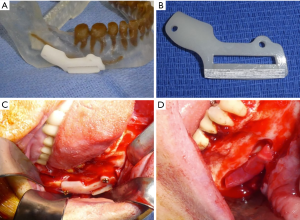
神经外松解术是将神经从其周围组织中游离,并清除可能干扰神经功能检查和神经修复的瘢痕组织的过程[39]。对于中度感觉障碍的患者,去除神经周围的瘢痕组织,进行神经减压就足以促进感觉恢复[39]。此时还必须清除神经周围的所有异物,包括根管填充材料、残留牙齿或植入材料(图3D)[39]。
神经内松解术极少采用,除非有神经纤维化证据。该手术需切开神经外膜以暴露内部神经束(神经束外的外膜切开术),松解神经纤维化的部分,以利于神经的扩张和减压。对于无法进行神经内松解术的患者,应彻底切除受累的神经节段,并通过一期神经断端吻合或神经移植来修复神经缺损[39]。
一旦神经瘤形成,应予切除,对残留的近心端和远心端,应检查是否有束间组织嵌入,直至正常神经断端, 3针或4针尼龙线缝合神经外膜(图4)[39]。如果神经拉拢后仍存在张力,则需要进一步解剖游离神经的近心端和远心端来消除张力。如果采用此方法后,神经断端仍存在连续性缺损,需要进行神经移植来修复。从以往研究来看,三叉神经损伤的移植常选用自体神经,最常见的是腓肠神经和耳大神经,因为它们易于获取且供区并发症少[40]。然而,上述供体神经和三叉神经之间的神经直径和神经束数量往往存在差异[41],这种差异可能导致神经再生和感觉功能恢复的可能性降低[41]。治疗三叉神经缺损的另一种方法是使用同种异体神经移植。目前,Avance®(Axogen,Alachua,Florida)是唯一经FDA批准的人类神经同种异体移植物[42]。与自体神经移植相比,同种异体神经移植的优点包括无需供体神经、缩短了手术时间和增加神经移植长度。移植物以前述方式与损伤神经近心端和远心端的神经外膜缝合(图3D, 图5A)。可以在神经吻合处包裹神经支架导管,在整个愈合过程中隔离周围组织,保护神经修复。还可以用纤维蛋白胶将神经支架导管加以固定(图5B)。常用的神经支架导管是胶原管,如NeuraGen®(Integra LifeSciences Corporation, Plainsboro, NJ)和Axoguard®((Axogen, Alachua, Florida)。
三叉神经显微外科手术:疗效
记录三叉神经显微外科手术疗效的文献较少,大多数可用数据均来自单个和系列病例报道。在一项对舌神经和下牙槽神经损伤的5年随访研究中,Pogrel发现,下牙槽神经组的手术疗效略好于舌神经组[43],且早期修复(损伤后10周内进行)的疗效优于晚期修复[43]。该研究结果还显示,如果患者在术前没有感觉障碍,术后也不会出现感觉障碍[43]。故Pogrel得出结论,在符合三叉神经显微外科手术指证的前提下进行该手术,超过50%患者的感觉障碍得到改善[43]。Bagheri等进行的一项类似的回顾性队列研究中,调查了167例接受下牙槽神经显微外科修复的患者的FSR[44],其中,88.9%接受一期神经吻合术的患者、85%接受神经外松解术的患者、75%接受神经内松解术的患者和70.6%仅进行外生性神经瘤切除的患者达到FSR[44]。Bagheri还对222例舌神经损伤进行各类手术治疗的患者进行了回顾性分析,如神经内松解术、神经吻合术或自体神经移植术[32]。他发现90.5%接受显微手术的患者FSR达到S3或更高,只有9.5%的患者没有改善[32]。使用同种异体神经移植进行间接修复的研究也显示了较好的预后。最近的一项研究评估了同种异体神经移植物治疗的8例舌神经损伤患者和8例下牙槽神经损伤患者,发现除1例患者外,其他患者在随访期间均实现了功能性感觉恢复[45]。
最近,有人提出在三叉神经显微外科手术中使用富含血小板的血浆(platelet-rich plasma,PRP)作为促进神经恢复的一种方法。PRP已在其他口腔手术中使用多年,如颌骨重建和牙种植手术,并取得了成功。通过将患者自身血液离心,去除红细胞,留下富含生长因子和蛋白质的血小板,即可获得PRP[46]。血小板脱去α颗粒后,许多促生长分子释放到周围环境中,进而发挥促组织修复的作用[46]。许多研究证实了使用PRP可促进软组织愈合,但其对周围神经再生作用的研究较少。在一项动物实验中,Cho等切断了20只白化豚鼠的面神经,对比了两种神经修复方法,对照组仅行神经吻合术,实验组采用神经吻合联合PRP[47]。在修复后第4周和第6周,实验组豚鼠在临床检查和电生理检测方面较对照组有显著改善[47]。经组织学分析,实验组的有髓轴突的数量较对照组显著增加[47]。基于这些初步结果,PRP和其他类似的生物材料在周围神经修复中的应用值得进一步研究。由于三叉神经显微外科仍处于初级阶段,尚需更多关于手术结果的公开数据以进行治疗策略评估。
Acknowledgments
Funding: None.
Footnote
Reporting Checklist: The authors have completed the Narrative Review reporting checklist. Available at https://fomm.amegroups.org/article/view/10.21037/fomm-21-26/rc
Peer Review File: Available at https://fomm.amegroups.org/article/view/10.21037/fomm-21-26/prf
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at https://fomm.amegroups.org/article/view/10.21037/fomm-21-26/coif). VBZ serves as an unpaid editorial board member of Frontiers of Oral and Maxillofacial Medicine from Nov 2019 to Oct 2021. VBZ serves as consultant for Axogen, Alachua, FL. The other author has no conflict of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Frequency of trigeminal nerve injuries following third molar removal. Br Dent J 2005;199:579. [Crossref]
- Ziccardi VB, Assael LA. Mechanisms of trigeminal nerve injuries. Atlas Oral Maxillofac Surg Clin North Am 2001;9:1-11. [Crossref] [PubMed]
- Meshram VS, Meshram PV, Lambade P. Assessment of nerve injuries after surgical removal of mandibular third molar: a prospective study. Asian J Neurosci 2013;2013: [Crossref]
- Dias GJ, de Silva RK, Shah T, et al. Multivariate assessment of site of lingual nerve. Br J Oral Maxillofac Surg 2015;53:347-51. [Crossref] [PubMed]
- Miloro M, Halkias LE, Slone HW, et al. MRI of the inferior alveolar nerve and lingual nerve-anatomical variation and morphometric benchmark values of nerve diameters in healthy subjects. Clin Oral Investig 2020;24:2625-34. [Crossref] [PubMed]
- Valmaseda-Castellón E, Berini-Aytés L, Gay-Escoda C. Lingual nerve damage after third lower molar surgical extraction. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000;90:567-73. [Crossref] [PubMed]
- Burian E, Probst FA, Weidlich D, et al. MRI of the inferior alveolar nerve and lingual nerve-anatomical variation and morphometric benchmark values of nerve diameters in healthy subjects. Clin Oral Investig 2020;24:2625-34. [Crossref] [PubMed]
- Lata J, Tiwari AK. Incidence of lingual nerve paraesthesia following mandibular third molar surgery. Natl J Maxillofac Surg 2011;2:137-40. [Crossref] [PubMed]
- Szalma J, Lempel E, Jeges S, et al. Darkening of third molar roots: panoramic radiographic associations with inferior alveolar nerve exposure. J Oral Maxillofac Surg 2011;69:1544-9. [Crossref] [PubMed]
- Sarikov R, Juodzbalys G. Inferior alveolar nerve injury after mandibular third molar extraction: a literature review. J Oral Maxillofac Res 2014;5:e1 [Crossref] [PubMed]
- Martin A, Perinetti G, Costantinides F, et al. Coronectomy as a surgical approach to impacted mandibular third molars: a systematic review. Head Face Med 2015;11:9. [Crossref] [PubMed]
- Pogrel MA, Thamby S. Permanent nerve involvement resulting from inferior alveolar nerve blocks. J Am Dent Assoc 2000;131:901-7. [Crossref] [PubMed]
- Ozen T, Orhan K, Gorur I, et al. Efficacy of low level laser therapy on neurosensory recovery after injury to the inferior alveolar nerve. Head Face Med 2006;2:3. [Crossref] [PubMed]
- Iyengar AR, Patil S, Nagesh KS, et al. Detection of anterior loop and other patterns of entry of mental nerve into the mental foramen: A radiographic study in panoramic images. J Dent Implant 2013;3:21-5. [Crossref]
- Juodzbalys G, Wang HL, Sabalys G. Injury of the Inferior Alveolar Nerve during Implant Placement: a Literature Review. J Oral Maxillofac Res 2011;2:e1 [Crossref] [PubMed]
- Renton T. Prevention of iatrogenic inferior alveolar nerve injuries in relation to dental procedures. Dent Update 2010;37:350-2, 354-6, 358-60 passim. [Crossref] [PubMed]
- Papaspyridakos P, De Souza A, Vazouras K, et al. Survival rates of short dental implants (≤6 mm) compared with implants longer than 6 mm in posterior jaw areas: A meta-analysis. Clin Oral Implants Res 2018;29:8-20. [Crossref] [PubMed]
- Chen YT, Chiu YW, Peng CY. Preservation of Inferior Alveolar Nerve Using the Dynamic Dental Implant Navigation System. J Oral Maxillofac Surg 2020;78:678-9. [Crossref] [PubMed]
- Abayev B, Juodzbalys G. Inferior alveolar nerve lateralization and transposition for dental implant placement. Part I: a systematic review of surgical techniques. J Oral Maxillofac Res 2015;6:e2 [Crossref] [PubMed]
- Dempf R, Hausamen JE. Lesions of the inferior alveolar nerve arising from endodontic treatment. Aust Endod J 2000;26:67-71. [Crossref] [PubMed]
- Marques TM, Gomes JM. Decompression of inferior alveolar nerve: case report. J Can Dent Assoc 2011;77:b34. [PubMed]
- Hanzelka T, Foltán R, Pavlíková G, et al. The role of intraoperative positioning of the inferior alveolar nerve on postoperative paresthesia after bilateral sagittal split osteotomy of the mandible: prospective clinical study. Int J Oral Maxillofac Surg 2011;40:901-6. [Crossref] [PubMed]
- Ousterhout DK. Sliding genioplasty, avoiding mental nerve injuries. J Craniofac Surg 1996;7:297-8. [Crossref] [PubMed]
- Garg S, Kaur S. Evaluation of Post-operative Complication Rate of Le Fort I Osteotomy: A Retrospective and Prospective Study. J Maxillofac Oral Surg 2014;13:120-7. [Crossref] [PubMed]
- Weinberg S, Kryshtalskyj B. Analysis of facial and trigeminal nerve function after arthroscopic surgery of the temporomandibular joint. J Oral Maxillofac Surg 1996;54:40-3; discussion 43-4. [Crossref] [PubMed]
- Schenkel JS, Jacobsen C, Rostetter C, et al. Inferior alveolar nerve function after open reduction and internal fixation of mandibular fractures. J Craniomaxillofac Surg 2016;44:743-8. [Crossref] [PubMed]
- Amole O, Osunde O, Akhiwu B, et al. A 14-Year Review of Craniomaxillofacial Gunshot Wounds in a Resource-Limited Setting. Craniomaxillofac Trauma Reconstr 2017;10:130-7. [Crossref] [PubMed]
- Westermark A, Jensen J, Sindet-Pedersen S. Zygomatic fractures and infraorbital nerve disturbances. Miniplate osteosynthesis vs. other treatment modalities. Oral Surg Oral Diagn 1992;3:27-30. [PubMed]
- Strong EB. Frontal sinus fractures: current concepts. Craniomaxillofac Trauma Reconstr 2009;2:161-75. [Crossref] [PubMed]
- Song Q, Li S, Patil PM. Inferior alveolar and mental nerve injuries associated with open reduction and internal fixation of mandibular fractures: a Seven Year retrospective study. J Craniomaxillofac Surg 2014;42:1378-81. [Crossref] [PubMed]
- Majoie CB, Verbeeten B Jr, Dol JA, et al. Trigeminal neuropathy: evaluation with MR imaging. Radiographics 1995;15:795-811. [Crossref] [PubMed]
- Bagheri SC, Meyer RA, Khan HA, et al. Retrospective review of microsurgical repair of 222 lingual nerve injuries. J Oral Maxillofac Surg 2010;68:715-23. [Crossref] [PubMed]
- Chhabra A, Ahlawat S, Belzberg A, et al. Peripheral nerve injury grading simplified on MR neurography: As referenced to Seddon and Sunderland classifications. Indian J Radiol Imaging 2014;24:217-24. [Crossref] [PubMed]
- Uddin Z, MacDermid JC. Quantitative Sensory Testing in Chronic Musculoskeletal Pain. Pain Med 2016;17:1694-703. [Crossref] [PubMed]
- Yekta SS, Koch F, Grosjean MB, et al. Analysis of trigeminal nerve disorders after oral and maxillofacial intervention. Head Face Med 2010;6:24. [Crossref] [PubMed]
- Ziccardi VB, Zuniga JR. Nerve injuries after third molar removal. Oral Maxillofac Surg Clin North Am 2007;19:105-15. vii. [Crossref] [PubMed]
- Ziccardi VB, Steinberg MJ. Timing of trigeminal nerve microsurgery: a review of the literature. J Oral Maxillofac Surg 2007;65:1341-5. [Crossref] [PubMed]
- Zuniga JR, Mistry C, Tikhonov I, et al. Magnetic Resonance Neurography of Traumatic and Nontraumatic Peripheral Trigeminal Neuropathies. J Oral Maxillofac Surg 2018;76:725-36. [Crossref] [PubMed]
- Ziccardi VB. Microsurgical techniques for repair of the inferior alveolar and lingual nerves. Atlas Oral Maxillofac Surg Clin North Am 2011;19:79-90. [Crossref] [PubMed]
- Wolford LM, Stevao EL. Considerations in nerve repair. Proc (Bayl Univ Med Cent) 2003;16:152-6. [Crossref] [PubMed]
- Jones RH. Repair of the trigeminal nerve: a review. Aust Dent J 2010;55:112-9. [Crossref] [PubMed]
- Kornfeld T, Vogt PM, Radtke C. Nerve grafting for peripheral nerve injuries with extended defect sizes. Wien Med Wochenschr 2019;169:240-51. [Crossref] [PubMed]
- Pogrel MA. The results of microneurosurgery of the inferior alveolar and lingual nerve. J Oral Maxillofac Surg 2002;60:485-9. [Crossref] [PubMed]
- Bagheri SC, Meyer RA, Cho SH, et al. Microsurgical repair of the inferior alveolar nerve: success rate and factors that adversely affect outcome. J Oral Maxillofac Surg 2012;70:1978-90. [Crossref] [PubMed]
- Yampolsky A, Ziccardi V, Chuang SK. Efficacy of Acellular Nerve Allografts in Trigeminal Nerve Reconstruction. J Oral Maxillofac Surg 2017;75:2230-4. [Crossref] [PubMed]
- Yu W, Wang J, Yin J. Platelet-rich plasma: a promising product for treatment of peripheral nerve regeneration after nerve injury. Int J Neurosci 2011;121:176-80. [Crossref] [PubMed]
- Cho HH, Jang S, Lee SC, et al. Effect of neural-induced mesenchymal stem cells and platelet-rich plasma on facial nerve regeneration in an acute nerve injury model. Laryngoscope 2010;120:907-13. [Crossref] [PubMed]

陈敏洁
博士,主任医师,硕士研究生导师。目前担任上海交通大学口腔医学院口腔颌面外科学系副主任、上海交通大学医学院附属第九人民医院口腔外科副主任、中华口腔医学会口腔颌面外科专业委员会委员、上海口腔医学会口腔颌面外科专业委员会委员、中华口腔医学会颞下颌关节暨牙合学专业委员会委员、上海市口腔医学会口腔颌面放射专业委员会常委。长期从事口腔颌面部神经疾病、颞下颌关节疾病、颌骨疾病的诊治。主持国家级和省部级课题10余项,在国内外期刊发表学术论文70余篇,SCI收录32篇,主译专著1部,参编专著8部。授权专利6项。以第三完成人获国家科技进步二等奖(2020)、第二完成人获上海市科技进步一等奖(2019)、第三完成人获教育部科技进步二等奖(2019)。(本译文仅供学术交流,实际内容请以英文原文为准。)(更新时间2022-09-01)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Schiavone M, Ziccardi VB. Trigeminal nerve injuries in oral and maxillofacial surgery: a literature review. Front Oral Maxillofac Med 2021;3:28.





