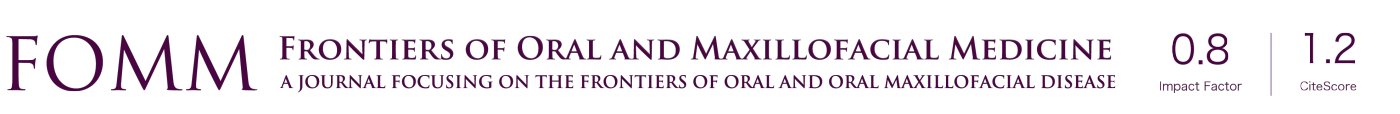新兴技术在颞下颌关节(TMJ)外科治疗中的应用
介绍
TMJ由上方颅骨上的颞骨和下方的下颌骨,以及居于两者之间的关节盘,以及关节囊和囊内外韧带等部分构成,有着支持个体的咀嚼、吞咽和语言等功能。TMJ功能紊乱可能对人们的日常生活产生严重后果。对于晚期颞下颌关节紊乱病(TMD)可能需要积极的外科手术干预治疗,以恢复TMJ的功能。外科手术治疗包括:关节腔内注射治疗药物、关节穿刺术、关节镜外科手术、功能性关节盘复位、髁突切除术、关节结节切除术、关节盘摘除术或者TMJ全关节置换术[1]。
因先天性发育不全、骨关节炎、关节强直、肿瘤或者创伤等引起的严重的进行性关节病,同时伴有功能丧失需要更为积极的治疗方法,例如同种异体TMJ全关节置换移植术。研究表明,用异体移植物完全替代TMJ的结果具有优异效果[2]。全关节置换术是利用组织工程方法来构建并模拟其需要置换的正常的TMJ的解剖结构,同时能降低患者发病率和平均住院时间。根据沃尔夫定律(Wolff’s law)[1],这些组织工程装置具有易于适应手术部位和随着时间推移进行改造的优点。随着近年来生物技术的发展,包括智能生物材料、4D打印、支架开发和生物力学/电刺激等,与TMJ外科手术不断发展的未来直接相关,并且对TMJ修复和重建的组织工程方法是一种补充。本文探讨了如何将其中几种新兴技术纳入TMD未来的外科手术管理和治疗中。
智能生物材料
构造支架的生物材料随时间的推移而变化。第一代的生物材料由单一的无源元件支架(物理、化学、生物或材料)组成,而第二代的生物材料是两个元件支架,由纳米纤维与小分子或者是复合陶瓷/聚合物支架构成。这使得“智能”材料越来越复杂,最终形成多元件支架,并与周围环境交互沟通[3,4]。
智能生物材料支架可以直接植入体内,利用小分子以达到生长因子释放的动力学和时间控制的目的,来影响药物的输送。小分子具有选择性、有效性、水溶性以及细胞渗透性等优点:这些特性使得小分子可用于组织工程和再生医学。通过构建达到纳米级别的纳米纤维支架来模仿本体细胞外基质。电纺丝技术过程中产生纳米支架,而该过程可以根据正在修复的特定组织的需要产生定制纤维支架[4]。
智能生物材料利用电纺丝技术产生广泛的治疗用途,包括修复血管、神经组织、软骨和骨组织缺陷以及应用于软组织的修复。电纺丝过程是通过带喷嘴的注射器将聚合溶液泵送至同一个系统中。聚合物溶液受到喷嘴和对电极之间电压的影响,使得聚合物溶液产生锥形形变。在这个过程中,聚合物溶液中的溶剂部分蒸发,形成连续的固体细丝。影响这一过程的因素多种多样,包括:环境参数、溶液特性,例如弹性、黏度、传导性和表面张力以及主导变量(例如电势差和电势、流速、聚合物分子量等)[5,6](图1)。
修复骨缺损(由癌症、创伤引起的)是电纺生物材料的重要应用。由于传统的电纺丝材料缺乏3D多孔结构,因而模拟本体骨细胞外基质(ECM)的结构非常困难,而这种多孔结构对于营养输送、血管内生、以及功能性组织再生等功能是必需的[7]。近来3D打印的电纺纳米支架快速发展起来,过程包括纳米纤维制备、匀浆化、冷冻干燥和交叉连接。在这个过程中产生了纤维孔,成功模拟了ECM的结构(图1)[6]。
电纺丝生物材料在血管组织工程的未来中也起着重要作用。移植的自体血管或同源异种血管是术后产生主要并发症的部位,而手术同时也受到捐献者数量的限制[8]。用同轴电纺丝技术制备的肝素负载聚合物(L)己内酯(PLCL)纳米纤维材料是血管组织工程中的首选材料。该技术利用4D打印技术,肝素随着时间释放到周围组织中。此外,血管内皮生长因子(VEGFs)也可以以此种方式用于促进组织的愈合和再生。同时肝素和VEGF结合还拥有了抗凝剂的特性,这是有利的[9]。另外,增强型-VEGF支架上的内皮细胞计数显著增加,这意味着其在构造血管组织工程支架方面的重要性[10]。
首选可降解的仿生支架材料。因其具有无机羟基磷灰石涂层的生物可降解聚合物微球,可以控制蛋白质、DNA和小分子随时间释放的动能速率。通过控制组织工程领域的各种蛋白质、基因和细胞疗法释放的动能速率,来模拟人体内自然发生的过程[11]。电纺丝技术使我们能够生产具有适当生长因子的3D打印生物可降解支架,进而诱导产生骨组织/软骨组织和血管,用于下一步全关节假体置换术。
4D打印技术
生物打印技术是组织工程领域中最具影响力的发展之一。生物打印的最初目标是创造和构建固定于支架的组织,以取代坏死或缺失的组织。4D打印利用3D生物打印技术,随着时间变化,在第四维度方面使材料具有形态上的重要改变,以应对各种环境刺激(例如高温、电力和温度)[12]。最近,在4D打印技术过程中,演示了使用水凝胶和单向形状聚合物复合物的双向激活实验。溶剂分子扩散到聚合物网络中,水凝胶反应迅速地膨胀或收缩。单向形状记忆聚合物调节了两种状态转换发生的时间。在未来,使用4D打印技术,如通过创新性的缝合材料、支架以及药物贮存等,可能会使得微创关节镜手术产生进步[13]。
当材料受到刺激发生变形时,变形后的形状可以无限期的保持,直到再次受到适当的刺激,材料可以回复到原有形状。这叫做形状记忆效应。外科医生使用微创技术可以给患者带来显著性益处,例如:缩短手术时间、减小伤口规模和加速愈合。但是,由于微创手术的术区比较狭小,因此在这个空间内组织塑形是个很大的挑战。形状记忆聚合物可以植入狭小的空间内,在术中应用刺激,可以变化成为我们所需的形状,例如应用于关节镜微创外科手术(图2)[14]。

激发形状记忆聚合物回复到原始形状的刺激可能有很大的不同。最简单的例子是使用高温(水浴)使材料回复至原有形状,这称为单向形状记忆效应。此外,当材料畸变保持在一定限度内时,内部产生弹性应力场,可以通过热循环实现双向形状记忆效应。通过合成材料,可以实现三重形状记忆效应,每一部分有各自的特性对应所需的形状。在手术过程中身体产生的热量,对于热激发记忆聚合物而言是不利的。为了进一步的应用,规避热激发形状记忆聚合物这一问题,(I)可以使用冷却进行形状记忆回复,(II)或者使用光响应进行形状记忆回复[14]。形状记忆聚合物在外科手术中的应用是非常多的。例如支架、缝线和夹子都会用到该形状记忆聚合物[15]。
皮瓣预构技术
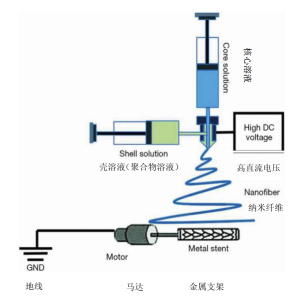
由于骨骼复杂的功能性和美学特性,通过移植来重建大的骨缺损是一项巨大的挑战。传统的骨组织工程(BTE)来修复较大的骨缺损,包含以下这些步骤:通过组织活检获得骨原细胞/干细胞,然后进行体外培养成长。由3D打印技术构造的生物可降解性生物支架,同时将骨原细胞/干细胞和生长因子移植进入,然后在体外生物反应器中培养。这最终形成一种具有可构建性和按预期形成的骨组织,移植到原来骨缺损的部位进行修复。这是骨组织重建手术中的传统组织工程方法的范例。
现今开发出一种皮瓣预构技术和将人体作为原位生物反应器结合的新技术,以取代传统方法中使用的体外生物反应器。这利用了人体自我再生新组织的能力,来突破体外生物反应器的限制。原位皮瓣预构技术是指带血管蒂骨瓣在原位人工再生为任何形状,以匹配任一部位的骨缺损。近年来,预构技术已经从皮瓣的血运重建和预置发展为再生,这也与组织工程技术的发展相关。现今该技术已经成功应用于动物和人类临界骨缺损的重建,并且直接应用于TMJ手术(图3)[16]。
生物力学/电刺激
生物工程的应用越来越广泛,包括使用生物物理学操纵人体本身对生长因子的需要,而这些应用于人体的生长因子可能会使FDA的批准更加困难。传统来说,再生生物学侧重于化学因子和转录网络;但是,内源性离子流是细胞行为的关键表观遗传调节器。内源性电压差、离子流和电力场等操纵细胞形态发生运动过程,以替代生长因子的作用[17]。
通过电力场提供的生物物理刺激,从而产生各种细胞效应:(I)改变带电细胞质分子的运动和浓度,(II)通过激活跨越细胞膜的生长调节离子转运来改变跨膜电位,或者(III)导致表面分子的电泳积累和改变细胞膜中的蛋白质构象[18]。通过直接的电容刺激,改变跨膜电位,从而打开电压门控钙离子通道(Ca++),来增加胞内Ca++浓度,而离子来自于细胞内的内质网(ER)。胞内Ca++浓度的增加使得钙调蛋白增多,这刺激了许多其他生长因子效应,结果包括:细胞增殖、碱性磷酸酯酶活性增加、细胞外基质(ECM)沉积作用增强以及各种生长因子浓度的增加,例如,VEGF,BMP-2,和 TGF-Beta 1[19]。
利用生物物理刺激来调节细胞膜极性的方法,可以影响干细胞分化成为不同系统的细胞,例如操纵间充质干细胞(MSC)分化成为软骨或者骨组织。理论上来说,这使得形成一个软骨支架成为可能,例如关节,通过在支架上(利用导电聚合物;见下一章节)种植未分化的MSCs和改变支架上任一部分的生物物理(电刺激)电压,引导细胞产生骨组织或者软骨组织,即关节重建中的骨移植。
导电聚合物
具有生物相容性和生物可降解性的新型导电聚合物可以用于生物传感器和“智能”组织工程支架。导电聚合物是一种有机聚合物,它比使用金属导电或半导体导电的能力要高。由导电聚合物组成的支架可以用于:修复/再生骨组织和/或软骨组织,作为主要支架或者用于主导/影响祖细胞/干细胞的活性(见前一章节)[3]。
例如,因创伤或者手术导致的严重外周神经损伤,运动和感觉功能的恢复受到限制,即完全性恢复的主要障碍。但是已经被证实的是,在术中对受损神经进行直接电刺激可以加速神经的功能性恢复,这进一步的表明了,在神经受损的患者中生物电刺激可以被用于治疗中。一种无线性、可程序化、生物可吸收性的电子系统装置已经被开发出来[12],它具有可持续性生物电神经-再生治疗能力。当坐骨神经受损后,将该装置移植进小鼠体内。袖口用生物可吸收性缝线固定在坐骨神经上,同时在皮下植入射频采集器。传输天线用于将射频波传递到装置上,为坐骨神经提供电刺激。对照组小鼠胫骨前肌的肌电图中(EMGs)表明,该装置能够在阈值以上水平产生神经刺激。该装置通过向受损的外周神经定期发送电脉冲,以促进神经的功能性恢复。它可在植入部位停留大约两周,然后被人体吸收降解(图4)[21,22]。

导电聚合物还可以应用于由交叉电极组成的特定位点支架。专门设计的可降解支架引发的受控电场,例如聚苯胺,在同一支架的不同部位,将人类骨髓基质细胞(HBMSC)分化为形成骨组织的成骨细胞和形成软骨组织的成软骨细胞,用于骨和软骨移植。交叉电极之间的距离和深度能够控制支架发出的电场强度,从而控制Ca++的流动速率[23]。Ca++浓度可以调节膜电位,并且影响细胞谱系的分化(骨组织和软骨组织)[24,25],从而有可能在同一支架上产生骨和软骨,例如全关节TMJ(图5)[25,26]。
压电效应和智能生物材料
细胞的信号通路利用电和化学突触进行交流,来重塑骨骼和软骨组织。设计一种可以利用电刺激来进行组织再生的生物材料,这一技术的难点在于电刺激的来源。传统来说,外部电极需要产生电场,通过压电效应来激活转导系统。可构成支架的压电材料有聚合物、陶瓷或复合材料。能表现压电性的材料,必须无对称中心和在其晶格结构中有特定特性[27]。当压电材料受到畸变或压力时可以产生电活动,从而避免的外部电力供应的需要。因此,当材料负载应用于系统时,压电支架被认为是一个灵敏的机电转导系统;机械刺激导致压电材料产生电活动,可用于增强目标位点的组织再生能力。压电材料同时也有可能应用于发电、结构健康监测以及组织工程设备开发[28]。手术后的骨组织和软骨组织极易发生变性。由于在骨和软骨组织中应用机电转导负载系统,而使得压电材料在手术方案的选择问题上展示出其优秀的特性,如可选择自体移植、同种异体移植和软骨细胞移植等[29]。
这种方法可以通过使用先前讨论的导电聚合物得到进一步的发展。刺激的来源可以是机械力,或者是电力(压电信号),又或是利用无线、生物可降解电力系统,使之成为持续性外源性生物电源或者是标准微型电池。
干细胞
干细胞与其环境生态位进行交流的一个手段是通过机械力。这些力通过与周围细胞外基质(ECM)相互作用来调节细胞的分化和自我复制更新的特性。这些力可以分类为内部产生的或外部产生的。肌肉收缩的力是内部产生的,与之相反的是作用于整个生命体的重力,这是外部力。此外,这些力有不同程度的效力,基于相互作用的特定组织/细胞的机械特性。例如,在典型的应力/应变关系曲线中,有效的、非永久性的材料状态转换可以定义为弹性。弹性形变是组织固有的特性,它改变了干细胞交流中机械力的转换。刚度矩阵和主动施加的力可以被用来操纵干细胞的分化和更新。而合成材料拥有这些特性。重要的是,这些材料的设计可以做到控制干细胞的自我更新、增值、分化以及器官形成等[30]。
而且,主动施加的外力可以刺激干细胞促进组织再生。临床实践中的牵张成骨术是这一特性最有利的证明,在骨组织上施加外部应力,来促进骨组织的形成。骨科植入物具有类似的功能,他们旨在促进应变介导效应在骨骼重塑和再生中的应用[31]。组织工程在将这一概念扩展到其他组织方面具有实质性意义。何种应力将会影响其他组织的再生,以及何种外加应力将会影响肌肉中的干细胞,这些问题随之而来。将来这一领域中的研究可能会解决这些问题。
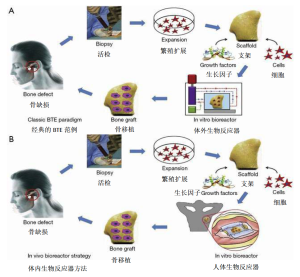
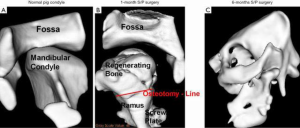
为了论证外部机械力可以促进髁突再生,在尤卡坦小型猪身上进行了髁突切除术实验。由生物可降解聚己内酯(PCL)材料组成的U型支架螺钉置入小型猪下颌升支后缘以取代髁突头。这些小猪体内立马开始TMJ的功能性重建。3个月后,一个新的髁突再生成功了[1]。该实验中的重点是,展示了组织工程中髁突结构改造的潜力,适应和改造功能促使重塑解剖上形态正确的髁突头,这符合沃尔夫定律(图6)[1]。
在关于内源性细胞归巢这一概念的研究中,构建了一个解剖学上形态正确的生物支架,以匹配兔子肱骨近端关节的表面形态。这是通过激光扫描和计算机辅助设计(CAD)进行重建完成的。肱骨近端髁关节表面进行手术切除,然后将解剖学上形态吻合的生物支架置于其上。10只兔子体内注入含有TGF-B3的生物支架,另外10只体内注入无TGF-B3的生物支架,还有3只兔子切除关节面后无替换物。含有TGF-B3生物支架的兔子,在II型胶原蛋白基质中均匀地分布了软骨细胞,其厚度明显高于不含TGF-B3生物支架的兔子。这个研究论证了内源性细胞归巢这一概念的能力。在含有TGF-B3生物支架的兔子中,滑膜关节的全关节表面有再生能力,并且无需利用细胞移植技术[32]。这具有显著意义,因为利用细胞归巢可以产生一个简单的临床运载系统(相比较细胞移植),并且能最大限度的提高人体本身细胞的再生能力(相比较原位生物反应器)。
通过关节内注射将基因输送到关节
关节炎是一种慢性、不可治愈的疾病,通常是通过持续性的输送治疗药物以达到控制其破坏进程。一种方法是通过向关节内注射cDNAs,随着时间推移,在关节内持续性的生产内生性基因产物。在类风湿性关节炎和骨关节炎的临床实验中,利用逆转录病毒载体进行离体基因传递[33,34]。该实验有意思的是,使用腺相关病毒进行体内基因传递时,能够原位转换为软骨细胞。这些实验给骨关节炎疾病的治疗带来了希望(图7)[33,35]。
进行了多中心、双盲、III期临床实验,以评估膝关节骨关节炎患者细胞和基因治疗的疗效和安全性[33]。患有骨关节炎的163位患者接受了关节内注射未转化或者转化的软骨细胞(3:1),以及通过逆转录病毒载体转化为过度表达TGF-β1(TGC)。随着时间推移,效果显著。TGC使膝关节骨关节炎患者在功能和疼痛控制方面有显著改善。以52周为基线相比,国际膝关节文献委员会(IKDC)的评分也有了显著提升,即使这是一个主观量表,但是为患者提供整体的功能性评分。接受TGC治疗的患者展现出一种趋势,即生成更厚的软骨和软骨下骨的表面积(P>0.05)生长速率变得更缓慢。这是未观察到的意外不良事件。
结论
生物技术和组织工程在近年来取得了实质性的进展,并有可能影响TMJ的外科管理治疗。在未来,TMJ外科治疗将会受到静电纺丝技术和导电聚合物生物材料的影响以替代骨缺陷,使用生物物理和电刺激来替代生长因子,4D打印的形状记忆聚合物应用于微创手术,细胞归巢,将基因传递到关节以及使用CRISPR/Cas进行基因编辑。在这些领域的进一步研究将会给组织工程领域带来巨大变革,并以非侵入性和更有效的方式来加强未来再生医学和TMJ外科治疗的应用。
致谢
资金:无。
声明
出处和同行评议:本文受编辑部委托,《口腔颌面医学前沿》系列“颞下颌关节紊乱病的诊断和治疗管理-未来会如何?”这篇文章被发送到外部同行进行评议。
利益冲突:两位作者都完成了统一公开表格(https://fomm.amegroups.com/article/view/10.21037/fomm-2020-tjddm-03/coif)。该系列“颞下颌关节紊乱病的诊断和治疗管理-未来会如何?”受到编辑部委托,但是无任何基金或赞助。SEF担任该系列的无薪酬客座编辑,并在2019年8月到2021年7月间担任《口腔颌面医学前沿》无偿编辑委员会成员。SEF在提交作品之外,同时报告了组织工程系统的其他部分;另外,SEF还拥有美国专利 8,275,594 项,授权给Depuy/Synthes,颁发了美国专利8,478,422项,又颁发了美国专利9,943,410 项。作者没有其他经济问题需要声明。
道德声明:作者负责该工作的所有方面,以确保该项工作的每个部分的准确性和完整性。
开发访问声明:根据《知识共享属性-非商业性-禁止更改4.0国际许可证》(CCBY-NC-ND4.0)开放访问文章入口,该文章允许非商业性复制和发布,但是禁止更改或编辑,并且需要合理引用原始文章(包括相关的DOI和许可证以及正式出版文章的链接)。详见:https://creativecommons.org/licenses/by-nc-nd/4.0/。
References
- Santee W, Aronovich S, Feinberg S. Temporomandibular Joint Total Replacement - TMJ TJR. Switzerland: Springer International Publishing, 2016:281-96.
- Mercuri LG, Ali FA, Woolson R. Outcomes of total alloplastic replacement with periarticular autogenous fat grafting for management of reankylosis of the temporomandibular joint. J Oral Maxillofac Surg 2008;66:1794-803. [Crossref] [PubMed]
- Feinberg SE. “TMJ Future: Emerging Technologies”. Chicago, IL: TMJ Track: 100th Annual AAOMS Meeting, 2018.
- Carbone EJ, Jiang T, Nelson C, et al. Small molecule delivery through nanofibrous scaffolds for musculoskeletal regenerative engineering. Nanomedicine 2014;10:1691-9. [Crossref] [PubMed]
- Braghirolli DI, Steffens D, Pranke P, et al. Electrospinning for regenerative medicine: a review of the main topics. Drug Disc Today 2014;19:743-53. [Crossref] [PubMed]
- Ye K, Kuang H, You Z, et al. Electrospun Nanofibers for Tissue Engineering with Drug Loading and Release. Pharmaceutics 2019;11:182. [Crossref] [PubMed]
- Yao Q, Cosme JG, Xu T, et al. Three dimensional electrospun PCL/PLA blend nanofibrous scaffolds with significantly improved stem cells osteogenic differentiation and cranial bone formation. Biomaterials 2017;115:115-27. [Crossref] [PubMed]
- Chlupác J, Filová E, Bacáková L. Vascular prostheses: 50 years of advancement from synthetic towards tissue engineering and cell therapy. Rozhl Chir 2010;89:85-94. [PubMed]
- Chen X, Wang J, An Q, et al. Electrospun poly(l-lactic acid-co-ɛ-caprolactone) fibers loaded with heparin and vascular endothelial growth factor to improve blood compatibility and endothelial progenitor cell proliferation. Colloids Surf B Biointerfaces 2015;128:106-14. [Crossref] [PubMed]
- Guex AG, Hegemann D, Giraud MN, et al. Covalent immobilisation of VEGF on plasma-coated electrospun scaffolds for tissue engineering applications. Colloids Surf B Biointerfaces 2014;123:724-33. [Crossref] [PubMed]
- Jongpaiboonkit L, Franklin-Ford T, Murphy WL. Mineral-coated polymer microspheres for controlled protein binding and release. ACS Appl Mater Interfaces 2009;21:1960-3.
- Ge Q, Sakhaei AH, Lee H, et al. Multimaterial 4D Printing with Tailorable Shape Memory Polymers. Sci Rep 2016;6:31110. [Crossref] [PubMed]
- de Marco C, Pané S, Nelson BJ. 4D printing and robotics. Sci Robot 2018;3:eaau0449. [PubMed]
- Huang WM. Shape memory polymers (SMPs) – Current Research and Future Applications. Available online: http://azom.com/article.aspx?ArticleID=6038
- Lendlein A, Robert L. Biodegradable, elastic shape-memory polymers for potential biomedical applications. Science 2002;296:1673-6. [Crossref] [PubMed]
- Huang RL, Kobayashi E, Liu K, et al. Bone graft prefabrication following the in vivo bioreactor principle. EBioMedicine 2016;12:43-54. [Crossref] [PubMed]
- Levin M. Bioelectric mechanisms in regeneration: unique aspects and future perspectives. Semin Cell Dev Biol 2009;20:543-56. [Crossref] [PubMed]
- Thrivikraman G, Boda SK, Basu B. Unraveling the mechanistic effects of electric field stimulation towards directing stem cell fate and function: A tissue engineering perspective. Biomaterials 2018;150:60-86. [Crossref] [PubMed]
- Balint R, Cassidy NJ, Cartmell SH. Electrical stimulation: a novel tool for tissue engineering. Tissue Eng Part B Rev 2013;19:48-57. [Crossref] [PubMed]
- Clark CC, Wang W, Brighton CT. Up-regulation of expression of selected genes in human bone cells with specific capacitively coupled electric fields. J Orthop Res 2014;32:894-903. [Crossref] [PubMed]
- Koo J, MacEwan MR, Kang SK, et al. Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy. Nat Med 2018;24:1830. [Crossref] [PubMed]
- Fellman M. Biodegradable implant provides electrical stimulation that speeds nerve regeneration. Available online: http://news.northwestern.edu/stories/2018/october/researchs-demonstrate-first-example-of-a-bioresorbable-electronic-medicine/
- Mazlan NS, Ramli MM, Abdullah MM. Interdigitated electrodes as impedance and capacitance biosensors: a review. AIP Conference Proceedings 2017;1885. Available online: https://aip.scitation.org/doi/abs/10.1063/1.5002470
- Xu J, Wang W, Clark CC, et al. Signal transduction in electrically stimulated articular chondrocytes involves translocation of extracellular calcium through voltage-gated channels. Osteoarthritis Cartilage 2009;17:397-405. [Crossref] [PubMed]
- Wang Z, Clark CC, Brighton CT. Up-regulation of bone morphogenetic proteins in cultured murine bone cells with use of specific electric fields. J Bone Joint Surg Am 2006;88:1053-65. [Crossref] [PubMed]
- Epstein AJ, Feinberg SE, Hansford DJ, et al. Electrical Stimulation of Cell and Tissue Growth with Two- and Three- Dimensionally Patterned Electrodes for an inversion entitled: “Electrical Stimulation of Cell and Tissue Growth with Two- and Three-Dimensionally Patterned Electrodes”. United States Patent and Trademark Office: Patent number 8,478,422.
- Jacob J, More N, Kalia K, et al. Piezoelectric smart biomaterials for bone and cartilage tissue engineering. Inflamm Regen 2018;38:2. [Crossref] [PubMed]
- Tandon B, Blaker JJ, Cartmell SH. Piezoelectric materials as stimulatory biomedical materials and scaffolds for bone repair. Acta Biomater 2018;73:1-20. [Crossref] [PubMed]
- More N, Kapusetti G. Piezoelectric material–a promising approach for bone and cartilage regeneration. Medical Hypotheses 2017;108:10-6. [Crossref] [PubMed]
- Vining KH, Mooney DJ. Mechanical forces direct stem cell behaviour in development and regeneration. Nat Rev Mol Cell Biol 2017;18:728-42. [Crossref] [PubMed]
- Cilla M, Sara C, Duda GN. Strain shielding inspired re-design of proximal femoral stems for total hip arthroplasty. J Orthop Res 2017;35:2534-44. [Crossref] [PubMed]
- Zhen C, Yo K, Ayesha H, et al. TGF-β3 modulates the inflammatory environment and reduces scar formation following vocal fold mucosal injury in rats. Dis Model Mech 2014;7:83-91. [Crossref] [PubMed]
- Evans CH, Ghivizzani SC, et al. Gene delivery to joints by intra-articular injection. Hum Gene Ther 2018;29:2-14. [Crossref] [PubMed]
- Kim MK, Ha CW, In Y, et al. A multicenter, double-blind, phase III clinical trial to evaluate the efficacy and safety of a cell and gene therapy in knee osteoarthritis patients. Hum Gene Ther Clin Dev 2018;29:48-59. [Crossref] [PubMed]
- The Hospital for Sick Children “Joint and Tendon steroid injections using image guidance”. Available online: http://www.aboutkidshealth.ca/Article?contentid=2452&language=English

任振虎
口腔颌面外科学博士、副主任医师
上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科
上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科副主任医师。主要研究方向是口腔颌面头颈恶性肿瘤的精准外科治疗及缺损的精细重建。国际首创“Ren anastomosis”血管吻合方法,首次提出股前外侧一蒂双岛皮瓣的临床分类。以第一作者或通讯作者发表SCI论文20余篇,中文核心期刊论文10余篇,主持国家自然科学基金、省部级基金等各项科研项目8项。授权国家专利6项。参编专业著作2篇。多次在国内外学术会议作口头报告和壁报展示。担任第24届欧洲颅颌面大会章节主席。曾获得上海市优秀博士毕业生等各种荣誉。现任海南省儋州市口腔医学会副会长、全国卫管会精准医疗分会委员;Exploratory Research and Hypothesis in Medicine、《中国普通外科杂志》等学术期刊编委。
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Werkman DF, Feinberg SE. Emerging technologies in the surgical management and treatment of the temporomandibular joint: a narrative review. Front Oral Maxillofac Med 2020;2:30.