
咀嚼肌疼痛的诊断考虑、病理生理学理论及未来发展方向
引言
对于大约 80% 被诊断患有颞下颌关节紊乱病(TMD)的患者,最常见的诊断特征是肌肉相关性疼痛[1]。在一项利用颞下颌疾病研究诊断标准(RDC-TMD)评估的研究中,作者系统地回顾了6 项研究,共2491例受试者,1815例女性,676例男性,平均年龄为 23.4~46岁。关于一般人群中咀嚼肌疾病的患病率,尽管纳入的研究存在差异,但患病率在 6%~13.3% 之间。数据的Meta分析显示总体患病率为 9.7%[2]。
在另一项研究中,使用类似的方案,但重点是寻求 TMD 治疗中的被诊断患有肌肉疾病的患者,共462例,其中,女性占79.5%,平均年龄 39.2(范围:18~81)岁,据报道咀嚼肌疾病的患病率为 56.4%。仅肌肉疾病的诊断率为 19.9%,平均年龄为 38.6±12.9岁。作者指出,当重新评估采用更严格的诊断标准并消除不可靠的肌肉触诊部位时,能更准确地反映需要治疗的TMD患者的患病率[3]。本综述的目的是介绍肌肉疼痛的各种理论,回顾诊断分类系统,考虑各种病理生理学理论,并为咀嚼肌疼痛诊断和治疗管理的未来提供见解。
肌肉疼痛的理论
没有明确的理论可以完全解释怎么引起咀嚼肌的疼痛、相关的症状或长期肌肉疼痛的原因。目前,没有单一特征性的病因因素,因此肌肉疼痛被认为是“多因素的”共同作用的结果,从而使识别危险因素及其对其疾病作用的过程更具挑战性。
迄今为止,有几种假设模型/理论试图解释肌肉疼痛。第一个是在1942年提出的疼痛恶性循环模型(VCPM)[4]。它假设肌肉过度活跃和疼痛的循环是自我延续的,这表明异常姿势、过度或异常运动或精神压力等起始因素会导致肌肉疼痛。该理论假定肌肉疼痛,然后导致肌肉本身过度活跃或疲劳,然后使进一步的肌肉疼痛和功能障碍持续存在,从而持续循环[5,6]。不幸的是,由于与肌肉活动特征与方法学原则的潜在问题,致使研究结果仍然不一致。此外,向肌肉注射高渗盐水(一种治疗疼痛的溶液)报告肌肉活动没有变化[7,8]。
疼痛适应模型(PAM)[9]提出肌肉活动的改变是疼痛存在的结果。该理论推测肌肉功能的改变是“适应性的”,从而为肌肉免受潜在损伤提供了保护机制[9]。一些研究不支持 PAM [10-12]。此外,PAM没有考虑疼痛、神经可塑性、遗传学以及疼痛行为的个体间或个体差异的心理社会方面。
综合疼痛适应模型(IPAM)是一种更现代、更广泛的模型,它融合了VCPM和PAM理论的各个方面[5,6]。IPAM假设疼痛会影响运动活动,因为它依赖于独特的生物心理社会特征的复杂相互作用,以及个体感觉运动系统的解剖和功能复杂性 [5,6]。该模型基于以下假设:咀嚼系统具有适应性并且能够使用多种肌肉募集途径执行特定任务。然而,该模型的某些方面无法在人类研究中重现[5,6]。
IPAM的增强功能,即运动适应疼痛模型(MAPM),表明某个部位的有害刺激会导致肌肉内部和肌肉之间的活动重新分布。此外,纳入该模型的是高级大脑中枢(例如社会心理方面)的变化是确定重新分配的运动活动的最终性质的重要特征[13]。尽管该理论与临床和实验观察一致,但需要进一步验证和纵向研究来确认无法适应是否与长期后果有关。
诊断的分类系统
为任何实体疾病开发诊断分类系统并不容易。专门为TMD设计这样一个系统是一项更加复杂的任务,因为必须同时考虑身体和社会心理变量。根据Fillingim等的说法,理想的诊断分类系统应该满足以下标准:它应该包括属于所在领域的所有的临床疾病或障碍,在生物学上是合理的,以便症状和体征与已知的生物学过程一致,在疾病实体之间没有重叠,应该有常见症状,可靠且临床上易于使用[14]。
在1992年制定RDC-TMD[15]之前,缺乏任何特定的通用诊断分类系统。对于大多数肌肉疼痛,大多数研究根本没有将各种TMD疼痛区分为特定类别,这使得诊断相当异质。因此,由于不知道文献作者是在讨论肌肉疼痛、关节疼痛还是肌肉和关节疼痛,因此对TMD文献的分析很复杂。使用标准化和可靠的检查协议(表1),RDC-TMD是第一个试图区分最常见疼痛和非疼痛相关TMD 病症的诊断分类系统。该诊断分类系统的目的是仅包括临床专家小组可以明确区分和定义的TMD亚型。自出版以来,RDC-TMD已被翻译成多种语言,是TMD研究出版物中使用最广泛的诊断协议。它包括通过提供生理(轴I)和社会心理诊断(轴II)配置文件的双轴评估。RDC-TMD基于可靠且操作良好的诊断标准,旨在同时提供生理诊断以及识别可能影响其TMD表达和管理的其他相关患者特征。
RDC-TMD最初旨在成为普遍接受和使用的诊断分类系统的第一步。作者认识到,未来需要进一步调查和验证轴I 诊断算法的准确性,并重新评估轴II 诊断量表的临床实用性。随后进行了一项多中心研究,以综合评估RDC-TMD 的可靠性和有效性 [16]。
2014 年,希夫曼等[17]发表了颞下颌疾病诊断标准(DC-TMD),它代表了RDC-TMD的增强(表2)。DC-TMD还采用双轴评估,同样包含生理(轴I)和心理社会诊断(轴II)配置文件。DC-TMD专门将身体疾病分为最常见的疼痛和与疼痛无关的肌肉和关节状况。
进一步的增强是DC-TMD为临床医生和研究人员提供了一种通用语言。DC-TMD得到最常见肌肉疼痛状况的敏感性和特异性值的支持,提供了可接受的有效性。当敏感性≥70%且特异性≥95% 时,敏感性和特异性的诊断算法被认为是可以接受的[15]。然而,由于DC-TMD仅依赖于临床检查,因此某些关节疾病的诊断存在一些局限性。将来,可以通过添加颞下颌关节(TMJ)成像来加强这一方面。
DC-TMD的轴I 组件的补充和扩展是扩展的DC-TMD[18](表3)。该分类系统混合了25种证据和基于共识的咀嚼肌和TMJ条件,是对已纳入现有DC-TMD的12种最常见条件的补充。与之前的DC-TMD一样,扩展的TMD分类法严格遵循诊断算法和临床评估原则。不太常见的 TMD 病症的诊断标准来自基于共识的专家意见方法,因此需要进行现场测试以验证其有效性。
除了初步诊断外,扩展的DC-TMD故意排除一些极不常见的TMD条件,因为数据缺乏。因此,应注意使用为扩展TMD分类法中列出的不太常见的疾病制定的可操作诊断标准。这使得这个扩展的诊断分类系统不够全面,因为它最有可能随着时间的推移而被修饰。
为了满足对主要慢性疼痛疾病的循证诊断标准的需求,镇痛、麻醉和成瘾临床试验转化、创新、机会和网络协会(ACTTION)与美国食品和药物管理局(FDA)建立了公私合作伙伴关系,同时与美国疼痛学会(APS)共同开发了ACTTIONAPS疼痛分类法(AAPT)。AAPT的长期目标是促进对慢性疼痛及其治疗的科学理解[19]。AAPT已将TMD确定为一种常见的慢性疼痛状态,因此调整了DC-TMD诊断标准,以便将其转化为AAPT框架。该框架由以身体系统为代表的无序域组织。对于研究和临床目的,每个领域都由五个主要维度组成,每个维度都被认为是定义、诊断和分类任何慢性疼痛状况(包括TMD)的关键。这五个领域是:诊断标准的共同特征;医疗合并症;神经生物学、社会心理和功能后果,推定的神经生物学和社会心理机制;风险因素;和保护因素。因此,在口颌面部疼痛的领域内,AAPT中TMD被开发为一个循证分类系统,它提供了一套统一结构的多维标准[20](表4)的系统结合。
最近,代表多个组织和协会的国际个人合作小组制定了口颌面部疼痛国际分类(ICOP)[21]。该分类系统的组织者认为,迄今为止,还缺乏一个专门针对口颌面部疼痛的综合性、国际和普遍接受的分类系统。ICOP引入的指导性诊断标准原则是疼痛疾病的特征应该是重点,而不是它们的解剖位置。目标是制造一种用户友好的仪器,以加强口颌面部疼痛的研究和临床管理。ICOP中包括TMD诊断标准,这些标准已从DC-TMD中采用,仅包括疼痛的TMD条件(表5)。
尽管ICOP包含了DC-TMD中提出的许多术语和标准,但还是存在差异。关于肌肉疼痛,DC-TMD使用术语肌痛和肌筋膜疼痛;然而,ICOP使用了不同的术语——肌筋膜口颌面部疼痛,由于缺乏实质性证据将疼痛与肌肉内的特定结构或组织联系起来,因此坚持使用术语肌筋膜。此外,ICOP 将时间成分纳入诊断以及区分原发性和继发性疼痛。
随着与肌肉疼痛相关的新科学信息的发现,有必要扩大该类别的诊断标准的数量。新建肌肉疼痛诊断标准必须以证据为基础,需要对独立样本进行交叉验证,并进行彻底的现场测试。这必须适用于肌筋膜疼痛,因为目前还不确定这种情况是否可以归类为单一疾病,或者是否有多种亚型。不幸的是,也没有针对肌痛亚型的差异化治疗算法。因此,需要进一步调查以确定是否存在亚型,如果存在,了解它们的机制和定义这些亚型的临床意义将很重要[22]。
病理生理学理论
咀嚼肌疼痛的病理生理学尚不清楚,仍然是一个正在进行的研究领域。迄今为止的证据定义了肌肉、周围神经系统、中枢神经系统(CNS)和自主神经系统水平上复杂的多因素相互作用[23]。
咀嚼肌的急性疼痛是由伤害感受器的激活引起的。伤害感受器是感觉神经元,通过游离神经末梢与CNS连接,检测潜在的有害刺激,从而导致疼痛感知[24,25]。这些神经末梢可以被强烈的机械和炎症刺激敏化和激活,其中一些与咀嚼肌疼痛有关[25]。特别是,假设 pH 值降低,这是三磷酸腺苷(ATP)激活和质子(H+ 离子)释放的结果,可导致外周伤害性感受器激活并产生肌肉疼痛。这一系列事件与几种咀嚼性肌肉疼痛状况有关,包括局部肌痛、肌炎和肌痉挛[25]。此外,已经证明 ATP与P2X嘌呤受体3(P2X3)分子和H+与瞬时受体电位香草素1(TRPV1)和酸感应离子通道(ASICs)的结合导致咀嚼肌内的神经兴奋。这导致神经肽的产生,如物质P(SP)和降钙素相关肽(CGRP),导致内源性炎症物质如缓激肽和前列腺素E2的释放,有助于增加伤害感受器对外部刺激的敏感性,导致外周敏感[25](图 1)。
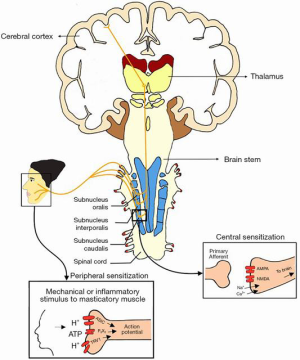
外周敏化是一种公认的生理事件,靠近疼痛区域的外周区域本身可能会随着时间的推移而变得疼痛,从而导致疼痛在更弥散的身体区域扩大。外周敏化的临床表现还包括异常性疼痛和痛觉过敏现象,并且可以深入了解为什么一些肌肉疼痛患者在正常功能性肌肉收缩、肌肉伸展甚至肌肉静止时会感到疼痛[26]。
随着时间的推移,持久性的外周敏化可以发展为中枢敏化,进一步增强疼痛敏感性。中枢敏化是伤害感受通路中神经元和回路“放电”的增加[27]。以前是亚阈值或沉默的突触输入,现在产生增加的动作电位输出。如果没有中枢敏化,单独机械过度使用肌肉不会导致慢性疼痛的发展[28]。在持续性咀嚼肌痛和肌筋膜痛患者中,伤害性刺激持续存在,并伴有中枢敏化[28,29]。
包括心理社会因素在内的其他几个因素可能会参与到这种疼痛增强过程中。口颌面部疼痛前瞻性评估和风险评估(OPPERA)研究是第一个专门探讨疼痛放大在TMD中的作用的大规模前瞻性研究,包括痛觉过敏、异常性疼痛和中枢敏化[30]。结果表明,与外周敏化类似,疼痛放大会导致对刺激的疼痛感增加[30]。涉及疼痛放大的机制包括减少疼痛抑制途径和增加疼痛促进途径。这些机制也已在痛阈较低或对机械压力或热刺激有较大疼痛反应的TMD患者中得到证实[29,31,32]。据报道,与对疼痛不敏感的人相比,对有害刺激敏感的人发生疼痛性TMD的机会更大(风险比为 2.7)[33]。此外,负责高级功能的各种大脑解剖位置发生变化,包括参与引发情绪和主观疼痛体验的位置的募集,以及影响记忆和学习过程[34]。虽然这些研究并非针对咀嚼肌痛,但推断疼痛放大效应可能导致咀嚼肌痛患者疼痛敏感性增加和疼痛发作似乎是合理的。
自主变量也被认为在急性和慢性状态下的咀嚼肌疼痛和TMD疼痛的病理生理学中发挥重要作用[23,35-39],似乎整体自主神经平衡倾向于有利于交感神经系统,TMD和持续性咀嚼肌疼痛患者的心脏副交感神经张力降低[40]。研究表明,静息时心率降低的TMD患者表现出对身体(直立性)和心理压力因素的自主神经活动功能障碍[30]。此外,除了压力感受器敏感性降低外,这些患者在执行身体和心理任务时表现出更高的心率[30]。这些发现表明交感神经活动中枢失调,导致TMD患者在休息和压力下的心脏交感神经活动增加和心脏副交感神经活动减少[30,40]。此外,有理论认为,交感神经活动的增强有助于肌肉骨骼疼痛状况的发作和慢性化。然而,目前的研究在预测TMD和咀嚼肌痛的发作方面缺乏重要的临床、社会心理和遗传变量,这些变量应作为未来研究咀嚼肌痛发作的多变量研究的一部分。
目前的文献表明,咀嚼肌疼痛的病理生理学是复杂的,并受多种不同危险因素的影响。目前尚不清楚是否某种危险因素导致咀嚼肌疼痛的发作,或者危险因素是咀嚼肌疼痛的后果。另一个悬而未决的问题是基线疼痛敏感性是否会影响咀嚼肌疼痛发生的疼痛严重程度和持续时间。未来对咀嚼肌疼痛发病机制的研究应该更密切地关注生物心理社会风险因素,以及它们与其发作和慢性的关系。这可能有助于更好地了解哪些患者易患慢性咀嚼肌疼痛。
未来诊断的方向
遗传学和蛋白质组学领域出现了一种未来研究的途径,它将彻底改变肌肉疼痛的诊断和分类。基因与疼痛体验密切相关,然而,必须指出的是,疼痛表达在很大程度上依赖于长期和持续的内部和外部环境相互作用,这些相互作用有能力改变基因并影响它们启动的蛋白质的功能。最终,这个过程会影响肌肉疼痛如何在整个疼痛体验的不同时间在整个神经系统中传递。
未来对肌肉疼痛的另一个重要考虑来自涉及中央信息处理的神经生物学影响,它解释了在整个身体中传播的与疼痛相关的信息的中央整合和处理。在这个过程中要考虑的重要概念是外周敏化、中枢敏化、记忆和学习过程及其对肌肉疼痛的影响 [34]。所有这些生物学过程将对诊断方案中分配给各种肌肉疼痛状况的标准产生深远的影响。
对遗传学作为TMD风险因素的作用的研究已经证明了不同的结果。毫无疑问,临床和实验性疼痛感知都受遗传因素和环境因素的影响[41]。几项研究估计,与TMD相关的疼痛相关疾病的遗传性范围为34%至58% [42-45]。
迄今为止,只有少数基因被发现与TMD和咀嚼肌痛有关。已知与TMD发展相关的两个特定基因是分解代谢酶儿茶酚-O甲基转移酶(COMT)和血清素2A受体(HTR2A)的内含子多态性[33,46,47]。在OPERA研究中,其他几个基因被认为是慢性TMD的潜在遗传危险因素,包括钙调素依赖性蛋白激酶4基因(CAMK4)、毒蕈碱胆碱能受体2基因(CHRM2)、G蛋白偶联受体激酶5基因(GRK5)、干扰素相关发育调节因子1基因(IFRD1)和糖皮质激素受体基因(NR3C1)[48]。总共有358个基因已知通过伤害感受和炎症途径导致慢性TMD。然而,需要进一步研究它们与咀嚼肌疼痛的关系[48]。
最近,有针对基因组测序和表观遗传学的研究。表观遗传学可以定义为不涉及DNA测序变化的基因表达模式的遗传。在表观遗传学领域,研究最多的机制是DNA甲基化。该机制涉及抑制转录因子的结合和抑制转录[49]。虽然与表观遗传和咀嚼肌疼痛相关的具体关系还有待研究,但已显示五种基因多态性与TMD发病有关[50]。多PDZ域蛋白(MPDZ)与基于时间的疼痛总和相关;前列腺素内过氧化物合酶1(PTGS1)和淀粉样β前体蛋白(AAP)与心理症状和压力有关;而血管紧张素I 转换酶2(ACE 2)和电压门控钠通道型1-α亚基(SCN1A)已被观察到与非特异性口腔和面部疼痛症状相关[50]。这些关键基因多态性为进一步研究急性和慢性TMD发病提供了潜在的领域,最终有助于识别那些在早期阶段有TMD和咀嚼肌疼痛风险的人。
生物标志物不仅可用于各种TMD疾病的早期诊断,还可用于评估治疗效果。在咀嚼肌疼痛的背景下评估生物标志物的研究有限。一些与局部和区域肌肉疼痛状况相关的研究表明,慢性肌痛患者的血清素、谷氨酸、乳酸和丙酮酸增加,但仍需要进一步研究[51]。
相关研究报告表明,多巴胺神经传递可以在慢性疼痛状况中发生中心变化,将其确定为潜在的全身生物标志物[52]。通常,肌筋膜疼痛患者的多巴胺会增加。目前的证据表明多巴胺增加与咬肌疼痛强度增加之间存在相关性[52]。这表明多巴胺也参与外周水平的疼痛调节。
据报道,与正常对照相比,TMD患者的基质金属肽酶(MMP)、蛋白聚糖酶和炎症介质水平升高[53,54]。具体而言,在慢性TMD肌肉疼痛患者中,研究发现氨基酸分泌增加,肌内细胞因子水平升高,包括 IL-6、IL-7、IL-8 和 IL-13,唾液中氧化应激生物标志物水平升高[55-57]。迄今为止,尚未发现TMD的金标准生物标志物,尤其是与咀嚼肌疼痛相关的生物标志物。鉴于其诊断潜力,未来应进一步研究发现TMD 和咀嚼肌痛的可行局部和全身生物标志物。
脑成像可能提供另一种工具,可在未来用于研究与持续性口面部疼痛(尤其是TMD)相关的大脑功能和结构的变化。利用功能磁共振成像(fMRI)的研究为神经性疼痛的病理基础提供了解释。功能成像提供大脑内被称为“疼痛矩阵”的区域的成像。该基质主要涉及丘脑、杏仁核、岛叶皮层、辅助运动区、前额叶皮层、感觉皮层和后顶叶皮层[58,59]。在疼痛矩阵内,躯体感觉丘脑皮质通路的变化也很明显[60]。研究报告称,通过脑成像,在患有慢性肌肉疼痛的TMD患者的疼痛矩阵中发现了一种常见的功能和结构改变模式[61,62]。此外,慢性口颌面部疼痛患者的前额叶皮层和边缘系统的功能和结构变化是明显的[58,59]。一项Meta分析强调了慢性口颌面部疼痛疾病患者的功能和灰质异常,特别是涉及咀嚼肌的患者[63]。与健康对照相比,研究发现慢性TMD患者的后壳核和右腹侧丘脑的灰质浓度在结构上更高[63,64]。从功能上讲,TMD患者的丘脑活动往往增加,但脑岛活动减少[63]。最终,这些脑成像研究虽然处于发展初期,但突出了功能磁共振成像作为调查和进一步了解 TMD 患者持续性咀嚼肌痛的工具的潜力。
结论
准确诊断的重要性在临床医学和牙科学中至关重要。如果没有正确的诊断,治疗计划的效果就会有限,并且在某些情况下,可能会导致治疗失败或进一步受损。自从引入RDC-TMD并演变为DC-TMD以来,现在有一个更加标准化和可靠的协议。诊断协议随着新的研究不断发展,最终形成了标准化和经过验证的全球诊断协议。咀嚼肌痛和TMD的病因和病理生理学被认为是多因素的,与生物、环境、遗传、心理社会、认知因素以及多种共病状况密切相关。不幸的是,没有明确的理论可以解释与咀嚼肌疼痛相关的发病和慢性症状。考虑到外周和中枢敏化的影响,认为PNS和CNS之间的复杂相互作用有助于产生咀嚼肌疼痛。
功能磁共振成像研究目前表明,在TMD和慢性疼痛患者中报告了常见的功能和结构变化模式。遗传学、表观遗传学和生物标志物的作用有可能应用于咀嚼肌疼痛的早期诊断和早期治疗或预防。该领域的这些及其他方面的研究无疑预示着在患者治疗管理方面取得重大突破的光明未来。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Stephen Feinberg and Louis Mercuri) for the series “Temporomandibular Joint Disorders Diagnosis and Management – What Does the Future Hold?” published in Frontiers of Oral and Maxillofacial Medicine. The article was sent for external peer review organized by the Guest Editors and the editorial office.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at https://fomm.amegroups.org/article/view/10.21037/fomm-20-33/coif). The series “Temporomandibular Joint Disorders Diagnosis and Management – What Does the Future Hold?” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- List T, Dworkin SF. Comparing TMD diagnoses and clinical findings at Swedish and US TMD centers using research diagnostic criteria for temporomandibular disorders. J Orofac Pain 1996;10:240-53. [PubMed]
- Manfredini D, Guarda-Nardini L, Winocur E, et al. Research diagnostic criteria for temporomandibular disorders: a systematic review of axis I epidemiologic findings. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2011;112:453-62. [Crossref] [PubMed]
- Manfredini D, Arveda N, Guarda-Nardini L, et al. Distribution of diagnoses in a population of patients with temporomandibular disorders. Oral Surg Oral Med Oral Pathol Oral Radiol 2012;114:e35-41. [Crossref] [PubMed]
- Travell JRS, Herman M. Pain and disability of the shoulder and arm treatment by intramuscular infiltration with procaine hydrochloride. J Am Dent Assoc 1942;120:417-22.
- Murray GM, Peck CC. Orofacial pain and jaw muscle activity: a new model. J Orofac Pain 2007;21:263-78. [PubMed]
- Peck CC, Murray GM, Gerzina TM. How does pain affect jaw muscle activity? The Integrated Pain Adaptation Model. Aust Dent J 2008;53:201-7. [Crossref] [PubMed]
- Svensson P, De Laat A, Graven-Nielsen T, et al. Experimental jaw-muscle pain does not change heteronymous H-reflexes in the human temporalis muscle. Exp Brain Res 1998;121:311-8. [Crossref] [PubMed]
- Matre DA, Sinkjaer T, Svensson P, et al. Experimental muscle pain increases the human stretch reflex. Pain 1998;75:331-9. [Crossref] [PubMed]
- Lund JP, Donga R, Widmer CG, et al. The pain-adaptation model: a discussion of the relationship between chronic musculoskeletal pain and motor activity. Can J Physiol Pharmacol 1991;69:683-94. [Crossref] [PubMed]
- Khawaja SN, McCall W Jr, Dunford R, et al. Infield masticatory muscle activity in subjects with pain-related temporomandibular disorders diagnoses. Orthod Craniofac Res 2015;18:137-45. [Crossref] [PubMed]
- Kumar A, Castrillon E, Svensson KG, et al. Effects of experimental craniofacial pain on fine jaw motor control: a placebo-controlled double-blinded study. Exp Brain Res 2015;233:1745-59. [Crossref] [PubMed]
- Ro JY, Svensson P, Capra N. Effects of experimental muscle pain on electromyographic activity of masticatory muscles in the rat. Muscle Nerve 2002;25:576-84. [Crossref] [PubMed]
- Hodges PW, Tucker K. Moving differently in pain: a new theory to explain the adaptation to pain. Pain 2011;152:S90-8. [Crossref] [PubMed]
- Fillingim RB, Bruehl S, Dworkin RH, et al. The ACTTION-American Pain Society Pain Taxonomy (AAPT): an evidence-based and multidimensional approach to classifying chronic pain conditions. J Pain 2014;15:241-9. [Crossref] [PubMed]
- Dworkin SF, LeResche L. Research diagnostic criteria for temporomandibular disorders: review, criteria, examinations and specifications, critique. J Craniomandib Disord 1992;6:301-55. [PubMed]
- Schiffman EL, Truelove EL, Ohrbach R, et al. The research diagnostic criteria for temporomandibular disorders. I: overview and methodology for assessment of validity. J Orofac Pain 2010;24:7-24. [PubMed]
- Schiffman E, Ohrbach R, Truelove E, et al. Diagnostic criteria for temporomandibular disorders (DC/TMD) for clinical and research applications: recommendations of the International RDC/TMD Consortium Network* and Orofacial Pain Special Interest Groupdagger. J Oral Facial Pain Headache 2014;28:6-27. [Crossref] [PubMed]
- Peck CC, Goulet JP, Lobbezoo F, et al. Expanding the taxonomy of the diagnostic criteria for temporomandibular disorders. J Oral Rehabil 2014;41:2-23. [Crossref] [PubMed]
- Dworkin RH, Bruehl S, Fillingim RB, et al. Multidimensional Diagnostic Criteria for Chronic Pain: Introduction to the ACTTION-American Pain Society Pain Taxonomy (AAPT). J Pain 2016;17:T1-9. [Crossref] [PubMed]
- Ohrbach R, Dworkin SF. AAPT diagnostic criteria for chronic painful temporomandibular disorders. J Pain 2019;20:1276-92. [Crossref] [PubMed]
- International Classification of Orofacial Pain, 1st edition (ICOP). Cephalalgia 2020;40:129-221.
- Michelotti A, Alstergren P, Goulet JP, et al. Next steps in development of the diagnostic criteria for temporomandibular disorders (DC/TMD): Recommendations from the International RDC/TMD Consortium Network workshop. J Oral Rehabil 2016;43:453-67. [Crossref] [PubMed]
- Svensson P, Kumar A. Assessment of risk factors for oro-facial pain and recent developments in classification: implications for management. J Oral Rehabil 2016;43:977-89. [Crossref] [PubMed]
- Gold MS, Gebhart GF. Nociceptor sensitization in pain pathogenesis. Nat Med 2010;16:1248-57. [Crossref] [PubMed]
- Mense S. Muscle pain: mechanisms and clinical significance. Dtsch Arztebl Int 2008;105:214-9. [PubMed]
- Sandkühler J. Models and mechanisms of hyperalgesia and allodynia. Physiol Rev 2009;89:707-58. [Crossref] [PubMed]
- Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity. J Pain 2009;10:895-926. [Crossref] [PubMed]
- Palla S, Farella M. Masticatory muscle pain. In: Mense S, Gerwin RD. editors. Muscle pain: diagnosis and treatment. Heidelberg: Springer, 2010:193-227.
- Sarlani E, Greenspan JD. Evidence for generalized hyperalgesia in temporomandibular disorders patients. Pain 2003;102:221-6. [Crossref] [PubMed]
- Maixner W, Diatchenko L, Dubner R, et al. Orofacial pain prospective evaluation and risk assessment study--the OPPERA study. J Pain 2011;12:T4-11.e1-2.
- Maixner W, Fillingim R, Booker D, et al. Sensitivity of patients with painful temporomandibular disorders to experimentally evoked pain. Pain 1995;63:341-51. [Crossref] [PubMed]
- Maixner W, Fillingim R, Sigurdsson A, et al. Sensitivity of patients with painful temporomandibular disorders to experimentally evoked pain: evidence for altered temporal summation of pain. Pain 1998;76:71-81. [Crossref] [PubMed]
- Diatchenko L, Slade GD, Nackley AG, et al. Genetic basis for individual variations in pain perception and the development of a chronic pain condition. Hum Mol Genet 2005;14:135-43. [Crossref] [PubMed]
- Dworkin SF. Research temporomandibular diagnostic criteria for disorders: current status & future relevance. J Oral Rehabil 2010;37:734-43. [Crossref] [PubMed]
- Slade GD, Fillingim RB, Sanders AE, et al. Summary of findings from the OPPERA prospective cohort study of incidence of first-onset temporomandibular disorder: implications and future directions. J Pain 2013;14:T116-24. [Crossref] [PubMed]
- Perry F, Heller PH, Kamiya J, et al. Altered autonomic function in patients with arthritis or with chronic myofascial pain. Pain 1989;39:77-84. [Crossref] [PubMed]
- Bragdon EE, Light KC, Costello NL, et al. Group differences in pain modulation: pain-free women compared to pain-free men and to women with TMD. Pain 2002;96:227-37. [Crossref] [PubMed]
- Carlson CR, Okeson JP, Falace DA, et al. Comparison of psychologic and physiologic functioning between patients with masticatory muscle pain and matched controls. J Orofac Pain 1993;7:15-22. [PubMed]
- Light KC, Bragdon EE, Grewen KM, et al. Adrenergic dysregulation and pain with and without acute beta-blockade in women with fibromyalgia and temporomandibular disorder. J Pain 2009;10:542-52. [Crossref] [PubMed]
- Furquim BD, Flamengui LMSP, Conti PCR. TMD and chronic pain: a current view. Dental Press J Orthod 2015;20:127-33. [Crossref] [PubMed]
- Diatchenko L, Nackley AG, Tchivileva IE, et al. Genetic architecture of human pain perception. Trends Genet 2007;23:605-13. [Crossref] [PubMed]
- Fejer R, Hartvigsen J, Kyvik KO. Heritability of neck pain: a population-based study of 33 794 Danish twins. Rheumatology (Oxford) 2006;45:589-94. [Crossref] [PubMed]
- Larsson B, Bille B, Pedersen NL. Genetic influence in headaches: a Swedish twin study. Headache 1995;35:513-9. [Crossref] [PubMed]
- Markkula R, Järvinen P, Leino-Arjas P, et al. Clustering of symptoms associated with fibromyalgia in a Finnish Twin Cohort. Eur J Pain 2009;13:744-50. [Crossref] [PubMed]
- Mulder EJ, Van Baal C, Gaist D, et al. Genetic and environmental influences on migraine: a twin study across six countries. Twin Res 2003;6:422-31. [Crossref] [PubMed]
- Mutlu N, Erdal M, Herken H, et al. T102C polymorphism of the 5‐HT2A receptor gene may be associated with temporomandibular dysfunction. Oral Dis 2004;10:349-52. [Crossref] [PubMed]
- Slade GD, Diatchenko L, Ohrbach R, et al. Orthodontic treatment, genetic factors, and risk of temporomandibular disorder. Semin Orthod 2008;14:146-56. [Crossref] [PubMed]
- Smith SB, Maixner DW, Greenspan JD, et al. Potential genetic risk factors for chronic TMD: genetic associations from the OPPERA case control study. J Pain 2011;12:T92-101. [Crossref] [PubMed]
- Fox SA, Tiwari L, Farah CS. Epigenetics and oral disease. In: Sonis S, Villa A. editors. Translational systems medicine and oral disease. London: Elsevier, 2020:163-206.
- Smith SB, Mir E, Bair E, et al. Genetic variants associated with development of TMD and its intermediate phenotypes: the genetic architecture of TMD in the OPPERA prospective cohort study. J Pain 2013;14:T91-101.e1-3.
- Gerdle B, Ghafouri B, Ernberg M, et al. Chronic musculoskeletal pain: review of mechanisms and biochemical biomarkers as assessed by the microdialysis technique. J Pain Res 2014;7:313-26. [Crossref] [PubMed]
- Dawson A, Stensson N, Ghafouri B, et al. Dopamine in plasma - a biomarker for myofascial TMD pain? J Headache Pain 2016;17:65. [Crossref] [PubMed]
- Srinivas R, Sorsa T, Tjäderhane L, et al. Matrix metalloproteinases in mild and severe temporomandibular joint internal derangement synovial fluid. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001;91:517-25. [Crossref] [PubMed]
- Tominaga K, Habu M, Sukedai M, et al. IL-1β, IL-1 receptor antagonist and soluble type II IL-1 receptor in synovial fluid of patients with temporomandibular disorders. Arch Oral Biol 2004;49:493-9. [Crossref] [PubMed]
- McGregor NR, Zerbes M, Niblett SH, et al. Pain intensity, illness duration, and protein catabolism in temporomandibular disorder patients with chronic muscle pain. J Orofac Pain 2003;17:112-24. [PubMed]
- Louca Jounger S, Christidis N, Svensson P, et al. Increased levels of intramuscular cytokines in patients with jaw muscle pain. J Headache Pain 2017;18:30. [Crossref] [PubMed]
- Rodríguez de Sotillo D, Velly AM, Hadley M, et al. Evidence of oxidative stress in temporomandibular disorders: a pilot study. J Oral Rehabil 2011;38:722-8. [Crossref] [PubMed]
- Apkarian AV, Bushnell MC, Treede RD, et al. Human brain mechanisms of pain perception and regulation in health and disease. Eur J Pain 2005;9:463-84. [Crossref] [PubMed]
- Apkarian AV, Hashmi JA, Baliki MN. Pain and the brain: specificity and plasticity of the brain in clinical chronic pain. Pain 2011;152:S49-64. [Crossref] [PubMed]
- Walton KD, Dubois M, Llinás RR. Abnormal thalamocortical activity in patients with Complex Regional Pain Syndrome (CRPS) type I. Pain 2010;150:41-51. [Crossref] [PubMed]
- Lin CS. Brain signature of chronic orofacial pain: a systematic review and meta-analysis on neuroimaging research of trigeminal neuropathic pain and temporomandibular joint disorders. PLoS One 2014;9:e94300. [Crossref] [PubMed]
- Scrivani S, Becerra L, DaSilva A, et al. Functional brain imaging of facial pain: functional magnetic resonance imaging (FMRI) studies of the trigeminal system. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2007;103:795.
- Ayoub LJ, Seminowicz DA, Moayedi M. A meta-analytic study of experimental and chronic orofacial pain excluding headache disorders. Neuroimage Clin 2018;20:901-12. [Crossref] [PubMed]
- Younger JW, Shen YF, Goddard G, et al. Chronic myofascial temporomandibular pain is associated with neural abnormalities in the trigeminal and limbic systems. Pain 2010;149:222-8. [Crossref] [PubMed]

方冬冬。安徽医科大学第二附属医院口腔颌面外科副主任医师,亚专科负责人
口腔颌面外科专科规培基地教学主任
现任安徽省口腔学会口腔颌面外科专业委员会常务委员,安徽省医学会显微外科分会第七届委员会委员。从事口腔医学专业临床工作十余年,长期致力于血小板浓缩物这种新型内源性治疗的药物在引导骨新生的机理方面的研究;在近年的临床工作中,已使用CGF在部分颌骨缺损患者的充填治疗中,已取得一定的疗效,发表中文核心期刊及SCI期刊论文共计11篇。目前主持院内临床培育研究项目一项,新技术新项目三项,其中微创技术联合可吸收固定系统在颌骨骨折中临床应用,已通过安徽医科大学认定为省内领先。主编专业著作一部,目前主持校院级科研项目两项。(更新时间:2021-11-19)

任振虎。口腔颌面外科,博士
上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科
上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科主治医师。主要研究方向是口腔颌面头颈恶性肿瘤的精准外科治疗及缺损的精细重建。国际首创“Ren anastomosis”血管吻合方法,首次提出股前外侧一蒂双岛皮瓣的临床分类。以第一作者或通讯作者发表SCI论文20余篇,中文核心期刊论文10余篇,主持国家自然科学基金、省部级基金等各项科研项目8项。授权国家专利6项。参编专业著作2篇。多次在国内外学术会议作口头报告和壁报展示。担任第24届欧洲颅颌面大会章节主席。曾获得上海市优秀博士毕业生等各种荣誉。现任海南省儋州市口腔医学会副会长、全国卫管会精准医疗分会委员;Exploratory Research and Hypothesis in Medicine、《中国普通外科杂志》等学术期刊编委。(更新时间:2021-11-19)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Klasser GD, Lau J, Tiwari L, Balasubramaniam R. Masticatory muscle pain: diagnostic considerations, pathophysiologic theories and future directions. Front Oral Maxillofac Med 2020;2:14.






