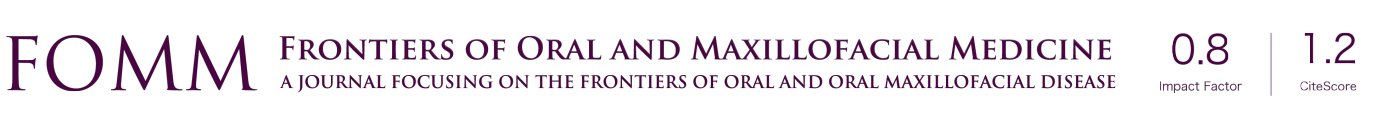颈部血管质量不佳的头颈部修复重建
前言
微血管游离皮瓣重建是头颈癌治疗的基石。显微外科治疗已经发展了70多年,并且已经取得了很好的效果,皮瓣存活率超过 95%[1,2]。头颈部游离组织移植成功的一个重要决定因素是用于显微血管吻合的游离皮瓣蒂和受区血管的质量。具有挑战性的重建病例见于颈部曾行手术治疗、联合/不联合化疗的放疗或手术联合放疗三种情况。接受过这些前期干预治疗的患者颈部解剖组织结构紊乱、炎症和血管瘢痕,可导致患者的颈部受区缺乏理想的血管。在头颈部接受微血管重建的所有患者中,约7%的患者可出现颈部血管质量不佳(VDN)[3]。通常情况下是从未受损区域寻求远端血管的移植。适合对VDN进行修复重建的血管选择很多,因而如何选择颇具挑战性。不幸的是,目前仍缺乏基于循证医学的方法,而多数文献报道是基于外科医生的个人经验[4]。针对这个问题,我们着手收集文献中可用的技术,以及基于实验或广泛流传并使用的解决方案。本文中,我们对VDN中的微血管重建进行评估,并对这些需要后期修复重建的患者提供治疗方法。
术前计划
任何手术都应进行详细的术前评估,这对于既往接受过治疗的患者尤为重要。完整的病史是必不可少的,并且通过完整的病史可确定患者的合并症和营养状况,以便深入了解颈部血管的健康状况和组织愈合能力。由于许多患者因吸烟而并发动脉粥样硬化,所以完整的病史应包括跛行症状史。详细回顾既往颈部的干预和治疗非常重要,包括手术、并发症和放疗。同样重要的是,详细的临床检查将得出关于颈部放疗后的变化、既往手术瘢痕、双侧颈外静脉的潜在通畅性以及可能影响血管或皮瓣选择的既往手术的证据。医患之间的共同决策对于制定护理计划至关重要。并非所有患者都适合手术治疗,在对风险和疗效进行讨论后应考虑替代疗法。这对接受二次修复重建手术且无癌症复发的患者尤其重要,因为这种选择性手术可以延迟实施而作为一种替代治疗。
处理VDN时,重要的是首先要根据既往病史、影像学和体格检查,考虑可能仍然存在受区血管并且可用。许多因素会影响受区血管的选择,包括缺损部位、血管解剖变异、可用受区血管的质量和吻合方法[5,6]。其中每一项都会对手术和效果产生重大影响[5]。理想情况下,受区动脉应无疤痕、无疾病、长度合适,并且口径与供体血管相似[7]。文献中的血管选择方法基于几个特征,包括易于解剖、既往可靠性、血管口径和接近缺损部位[7,8]。随后一个重要决定就是考虑应该获取哪个特定的游离皮瓣。选择具有合适特征、合适大小的蒂和长度的皮瓣是很重要的,但也必须与可用的受区血管相匹配。选择具有长血管蒂的皮瓣可以减少一些与到达远端受区血管相关的困难,但如果有必要切取具有短血管蒂的皮瓣,那么外科医生必须考虑使用静脉移植。这取决于外科医生的习惯和熟练程度,并且需要与患者就特定皮瓣的预期功能进行认真讨论,权衡其难度和皮瓣失败的风险。
VDN的术前影像学检查对于正确的手术计划同样重要。计算机断层扫描(CT)或磁共振成像(MRI)进行的对比成像可用于明确血管的通畅性,并可在之前的颈部治疗处提供解剖定位。双相CT血管造影是强化动脉和静脉血管系统的理想方法,通常是最重要的计划步骤[9]。单相位CT和MRI血管造影是显示动脉血流的一个好的选择,但不能提供高质量的静脉血管图像。通过从颅底到横膈膜的双相CT血管造影可以评估所有重要血管的通畅程度[10]。虽然影像学检查是一种有用的辅助手段,但它并不能取代术中对受区血管状况的评估。
动脉
VDN中的动脉选择多种多样,为每个手术病例选择合适的动脉比较困难。在表1中,我们展示了VDN所依赖的一系列动脉和静脉的相对优缺点。在接下来的章节中,我们进一步扩展讨论了血管的重建技术和应用。
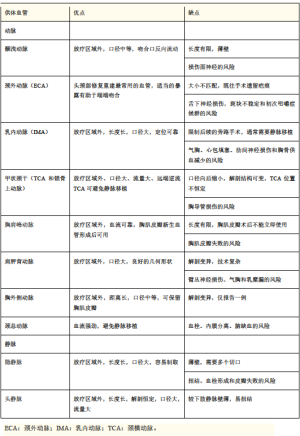
Full table
颈外动脉(ECA)
在正常颈部,ECA的分支比较可靠,并能很好地用于吻合。ECA发出六条分支,最终止于上颌动脉和颞浅动脉。这些分支动脉包括甲状腺上动脉、舌动脉和面动脉(前支)、咽升动脉(内侧支)以及枕动脉和耳后动脉(后支)。面动脉、甲状腺上动脉、颞浅动脉和舌动脉因其解剖位置恒定、长度、直径和良好的灌注而受到青睐。
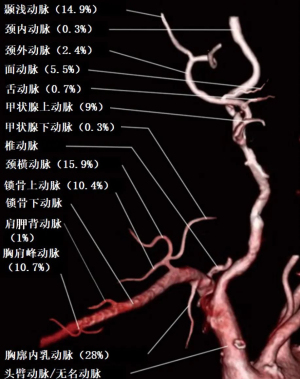
ECA的分支通常被视为金标准,但在VDN中,它们的实用性通常是有限的。这些血管大多数都位于既往手术和放疗区域内,疤痕较重且极难再次使用。此外,它们位于下颌骨下方,加之患者由于放疗导致颈部伸展受限,使得外科入路非常困难。VDN中使用最多的ECA分支是颞浅动脉,由于通常位于放疗区域之外,所以颞浅动脉的使用率可达14.9%,见图1[4]。颞浅动脉位于耳前区,与前额的眼动脉和枕动脉相连。即使在既往的手术中损失了ECA,该吻合也能提供良好的反向流动[10]。这种选择非常可靠,但因其长度、面神经损伤风险、壁薄和易扭结倾向而受到一定限制[10,11]。
当ECA的分支不可用时,可选择ECA转位和端端吻合使动脉流入游离皮瓣蒂[12]。通常情况下,ECA在I区和II区颈淋巴清扫中暴露,从而使入路更容易,切口更少。远端血管结扎可提供更大的受区血管长度和可能更简单的颈-下颌角以外的吻合[12]。这种暴露可以实现端端吻合,而不是更复杂的端侧缝合。其局限性包括大小不匹配和大脑侧支血管损伤的风险,特别是对于有狭窄血管或既往脑卒中史的高危患者[13]。舌下神经损伤、斑块的潜在不稳定性和初次咀嚼症候群也是需要考虑的可能并发症[14,15]。
乳内动脉(IMA)
IMA起源于锁骨下动脉,第二至第三肋间间隙是获取血管最可靠的位置。右侧IMA被认为是VDN中所有动脉吻合选择中最为可靠的[4],它的蒂较长、口径大、血管定位准确[3,16]。获取IMA和乳内静脉(IMV)主要有两种方法:传统方法,或较少使用的肋骨保留技术[16]。保留肋骨技术的主要用途是乳房重建,但当需要较大的皮瓣蒂或较少的受区血管长度时,它也可用于头颈部。鉴于这些血管在该领域中的独特用途,接受过头颈部整形外科培训的外科医生可能会更倾向这些血管。其主要缺点包括可能会出现气胸、肋间神经损伤、供区部位的外观畸形和胸骨供血减少[3,17]。此外,心脏压塞是一种罕见的并发症,后续可能进行的带内乳移植物的旁路手术是血管解剖的禁忌症[3,18]。
甲状颈干:颈横、锁骨上、甲状腺下动脉
从锁骨下动脉分支而来的甲状颈干,提供了另外一种新的选择。常用的颈横动脉(TCA)和锁骨上动脉通常从IV区底部的甲状颈干分支而来。这些血管具有理想的纵行方向,口径较大,可提供较大的血流量[19]。此外,它们通常位于4区颈淋巴结清扫术的筋膜下,不在先前的手术区域内。越靠近起始点,TCA的口径越大,随着其向后延伸,口径会大大减小,通常需要长蒂皮瓣或静脉间置移植物进行吻合[3]。然而,已经发现远端反向流动TCA是一种可靠的受体选择。当其他常见替代方案不可用时,无需进行长静脉移植即可到达远端受区血管[20]。其他困难包括解剖变异、CT血管造影检测位置不恒定以及可能的胸导管损伤[4]。
胸肩峰动脉
目前关于胸肩峰血管使用的文献仍然很少。然而,在既往未行胸大肌皮瓣重建的情况下,该血管通常未被解剖,可用于头颈部修复重建。此血管典型地分为四支:胸肌支、三角肌支、锁骨支和肩峰支[21]。胸肩峰静脉系统通常反映动脉分支。胸肩峰系统的解剖在别处进行说明[22],但通常在水平切开胸肌并仔细解剖组织平面后可看到分支。该系统的分支可以向远端进行解剖,以实现动脉在锁骨上的转位并进入颈部[22]。躯干可提供可靠的血流,通常在放疗和既往制取胸皮瓣后依旧可用[22,23]。
这项技术的主要缺点是可能伤及胸大肌皮瓣的主要血管蒂。然而,可以使用胸肩峰动脉的另一个分支进行吻合,并且可保留胸肌支。其他限制包括,若不久前带蒂皮瓣已被翻开,则不适合进行吻合;以及除非使用长血管蒂,否则可能需要静脉移植[3]。
肩胛背动脉(DSA)
关于VDN中使用DSA的文献很少,但我们之前已发表过关于其解剖方法的文章,并且发现该方法可靠,技术极为有用[24]。该血管的主要优点包括与常规治疗区域的距离较远、口径大和良好的几何形状。在大多数情况下,DSA从锁骨下动脉发出穿过颈后三角。值得注意的是,在近1/3的病例中可以发现DSA从TCA分支发出,并且与臂丛神经之间存在很大程度的解剖变异[25]。由于可能在解剖中暴露,所以必须注意臂丛神经和锁骨下动脉周围的结构。由于DSA通常位于臂丛神经上干的正上方,因此我们小组在解剖困难的情况下会使用多普勒技术。锁骨会使暴露变得困难。尽管通过仔细的剥离,血管可追溯至进入肩胛骨处并向上反射至颈部,但最大的局限性是血管的解剖位置较低,需要长血管蒂或静脉移植[24]。其他潜在风险包括气胸和乳糜漏,但我们并无相关经验。
胸外侧动脉(LTA)
LTA可以作为头颈部游离皮瓣微血管重建的受区血管,但据我们所知,文献中仅报道过一例[24]。该血管通常位于放疗区域外,且可以提供比胸肩峰系统更大的范围和口径。此外,它的制备相当简单,并可保留胸肩峰动脉的胸肌支,保留胸大肌皮瓣。LTA的解剖起点通常是腋动脉第二部分的一个分支,但也有差异[26]。在确定其真正的用途、直径、血流和潜在胸大肌瓣的风险之前,有必要进行更深入的研究。
颈总动脉
VDN中一种不太常见但可行的技术是使用颈总动脉。如果其他常见血管不可用,颈动脉端侧吻合可允许在不需要静脉移植的情况下进行强灌注[27]。这项技术比较危险,可导致脑缺血,但已经证明,只要通过开放的ECA有发达的侧支循环来维持颈内动脉灌注,该技术是可行的[28]。此外,一项研究表明,当ECA受损时,可以使用Pruitt-Inhara颈动脉分流器维持颈内动脉灌注,从而大大降低风险[27]。由于颈动脉粥样硬化斑块的形成增加了血栓和内膜分离的风险,因此无论潜在的效果如何,通常应避免使用颈总动脉端-侧技术[8]。
静脉
充分的静脉引流在VDN中至关重要,而其中最简单的选择是使用受区动脉分支的伴行静脉,如临床经常使用的乳腺血管、胸肩峰血管和甲状颈干血管。颈内静脉和颈外静脉也是用于吻合的主要静脉系统,但在VDN中可能无法使用[10]。如果皮瓣血管蒂较长且张力较小时,同样可以考虑使用对侧颈部的血管。人们经常考虑使用颈前静脉,但许多接受头颈部修复重建手术的患者将实施或已经实施过气管切开术。不幸的是,在气管切开术中,医源性颈前静脉损伤或造口周围的炎症使这些静脉非常不宜使用。
静脉也是修复重建中常用的工具,用于延长游离皮瓣蒂的范围。如果需要切取带短血管蒂的皮瓣,则应在切取游离皮瓣之前准备进行静脉移植。大隐静脉和小隐静脉因其长度长、口径大、易于获取而经常被使用。外科医生应仔细考虑选择血管,因为静脉移植物需要两个吻合部位,扭结、血栓形成的风险更高,并且据报道会使皮瓣失败的风险增加近24%[29]。
头静脉
头静脉是除颈内、外静脉系统外极好的选择。由于位于任何既往术区或放疗区域之外,因此该静脉在VDN中是有用的,其制备方法另有说明[30]。头静脉因其解剖位置恒定、蒂长、血流量大、口径大、血栓形成风险低等诸多优势,被认为是“救命血管”[4,31]。由于解剖简单、长度广泛,可通过锁骨上转位而到达同侧颈部的任何区域,因此近25%的情况下首选头静脉[4]。与下肢静脉相比,该静脉的主要局限性在于其血管壁较薄,并且在穿过锁骨时容易发生扭结[3]。
在VDN中,当不太容易获得合适的血管时,头静脉可用于制备corlett环[32]。头静脉远心端首先与ECA吻合;然后可将其分开用于一段或两段式重建[33]。其近心端与皮瓣静脉吻合,其远端与ECA相连,以皮瓣动脉[32]与之吻合。两段式动静脉瘘吻合方式失败率较高[33],迄今为止,仅一段式corlett环重建被报道在头颈部修复重建中成功应用[32]。且同时存在静脉扭曲的风险。在我们的机构中,我们避免使用两段式corlett环,这是因为两段式corlett环重建时血管可发生瘢痕化,以及血管动静脉瘘口较大可导致心力衰竭。
游离皮瓣的选择
广泛的游离微血管皮瓣选择可以让外科医生应对VDN的挑战。在确定了可用的血管后,有多种可供选择的游离皮瓣可以提供类似的功能及外观。然而,在VDN中,皮瓣选择最重要的标准是皮瓣的可靠性、修复重建适应证和缺损区域的形状[4]。往往优先选择体积较大且血供良好的皮瓣,以避免瘘管、伤口愈合问题和再次手术。
当VDN中的游离皮瓣具有更长的蒂时,更容易与远端受区血管吻合,可大大扩大其用途。最常用的包括基于穿支的股前外侧皮瓣和前臂桡侧游离皮瓣(RFFF),它们通常能提供适合VDN的所需长度和特征[4]。同样,与最长的血管蒂功能性结合的骨瓣,包括游离腓骨和肩胛骨皮瓣,在VDN中得到了广泛应用[4]。
对现有的皮瓣进行改良以提供所需的长度也在文献中得到了证实。一种技术是通过获取胸背动脉并使用胸背动脉远端进行吻合来延长肩胛骨游离皮瓣蒂[3]。这会在血液中产生反向流动至供应皮瓣的旋肩胛动脉。然而,静脉吻合可能仍然需要静脉移植,这种技术不需要将来使用背阔肌游离皮瓣[3]。
当没有其他选择时,另一种可行的技术包括使用RFFF建立血管桥或获取桡动脉用于动脉吻合[34]。在许多VDN技术中,受区缺损至皮瓣血管蒂之间较长的距离通常需要血管化的管道连接。当RFFF的血管蒂与第二个游离皮瓣吻合并支持其血供时,皮瓣的软组织有助于手术缺损的重建。静脉移植物和动静脉环都可被用作血管桥,但存在很大的风险[33]。使用可靠的RFFF作为血管化皮瓣导管可以增加皮瓣存活率及安全性。其潜在的缺点包括两个游离皮瓣的获取时间较长,以及在RFFF蒂血栓形成的情况下可导致两个皮瓣的损失[34]。
结论
VDN在高难度晚期修复重建的情况下极具挑战性。解决这些复杂的病例通常需要细致的手术计划和创造性的解决方案。详细的解剖学知识以及深刻了解每种动脉和静脉选择的益处和局限性是至关重要的。VDN的治疗证据极少,并且报道的技术仅限于个别外科医生的经验。这篇综述概述了大量已经验证的策略和创造性的解决方案,旨在为每位患者提供个性化的解决方案。
Acknowledgments
The authors would like to acknowledge Eric Wizauer for critical assistance with image procurement and figure development.
Funding: MEHN was funded by the NIH (T32 DC005356).
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Paolo Cariati) for the series “Microvascular reconstruction of head and neck oncological defects—state of the art” published in Frontiers of Oral and Maxillofacial Medicine. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at: https://fomm.amegroups.com/article/view/10.21037/fomm-20-38/coif). The series “Microvascular reconstruction of head and neck oncological defects—state of the art” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Khouri RK, Cooley BC, Kunselman AR, et al. A prospective study of microvascular free-flap surgery and outcome. Plast Reconstr Surg 1998;102:711-21. [Crossref] [PubMed]
- Suh JD, Sercarz JA, Abemayor E, et al. Analysis of outcome and complications in 400 cases of microvascular head and neck reconstruction. Arch Otolaryngol Head Neck Surg 2004;130:962-6. [Crossref] [PubMed]
- Jacobson AS, Eloy JA, Park E, et al. Vessel-depleted neck: techniques for achieving microvascular reconstruction. Head Neck 2008;30:201-7. [Crossref] [PubMed]
- Frohwitter G, Rau A, Kesting MR, et al. Microvascular reconstruction in the vessel depleted neck - A systematic review. J Craniomaxillofac Surg 2018;46:1652-8. [Crossref] [PubMed]
- Tan BK, Wong CH, Chen HC. Anatomic variations in head and neck reconstruction. Semin Plast Surg 2010;24:155-70. [Crossref] [PubMed]
- Nahabedian MY, Singh N, Deune EG, et al. Recipient vessel analysis for microvascular reconstruction of the head and neck. Ann Plast Surg 2004;52:148-55; discussion 56-7. [Crossref] [PubMed]
- Yazar S. Selection of recipient vessels in microsurgical free tissue reconstruction of head and neck defects. Microsurgery 2007;27:588-94. [Crossref] [PubMed]
- Chia HL, Wong CH, Tan BK, et al. An algorithm for recipient vessel selection in microsurgical head and neck reconstruction. J Reconstr Microsurg 2011;27:47-56. [Crossref] [PubMed]
- Du E, Patel S, Huang B, et al. Dual-phase CT angiography for presurgical planning in patients with vessel-depleted neck. Head Neck 2019;41:2929-36. [Crossref] [PubMed]
- Breik O, Praveen P, Parmar S. The vessel-depleted neck in head and neck microvascular reconstruction: extreme solutions for extreme situations. Curr Opin Otolaryngol Head Neck Surg 2020;28:129-35. [PubMed]
- Wong KK, Higgins KM, Enepekides DJ. Microvascular reconstruction in the vessel-depleted neck. Curr Opin Otolaryngol Head Neck Surg 2010;18:223-6. [Crossref] [PubMed]
- Garg RK, Poore SO, Wieland AM, et al. Recipient vessel selection in the difficult neck: Outcomes of external carotid artery transposition and end-to-end microvascular anastomosis. Microsurgery 2017;37:96-100. [Crossref] [PubMed]
- Dalainas I, Avgerinos ED, Daskalopoulos ME, et al. The critical role of the external carotid artery in cerebral perfusion of patients with total occlusion of the internal carotid artery. Int Angiol 2012;31:16-21. [PubMed]
- Kim T, Chung S, Lanzino G. Carotid artery-hypoglossal nerve relationships in the neck: an anatomical work. Neurol Res 2009;31:895-9. [Crossref] [PubMed]
- Laccourreye O, Werner A, Garcia D, et al. First bite syndrome. Eur Ann Otorhinolaryngol Head Neck Dis 2013;130:269-73. [Crossref] [PubMed]
- Roche NA, Houtmeyers P, Vermeersch HF, et al. The role of the internal mammary vessels as recipient vessels in secondary and tertiary head and neck reconstruction. J Plast Reconstr Aesthet Surg 2012;65:885-92. [Crossref] [PubMed]
- Carrier M, Grégoire J, Tronc F, et al. Effect of internal mammary artery dissection on sternal vascularization. Ann Thorac Surg 1992;53:115-9. [Crossref] [PubMed]
- Nahabedian MY. The internal mammary artery and vein as recipient vessels for microvascular breast reconstruction: are we burning a future bridge? Ann Plast Surg 2004;53:311-6. [Crossref] [PubMed]
- Urken ML, Vickery C, Weinberg H, et al. Geometry of the vascular pedicle in free tissue transfers to the head and neck. Arch Otolaryngol Head Neck Surg 1989;115:954-60. [Crossref] [PubMed]
- Ciudad P, Agko M, Manrique OJ, et al. The retrograde transverse cervical artery as a recipient vessel for free tissue transfer in complex head and neck reconstruction with a vessel-depleted neck. Microsurgery 2017;37:902-9. [Crossref] [PubMed]
- Reid CD, Taylor GI. The vascular territory of the acromiothoracic axis. Br J Plast Surg 1984;37:194-212. [Crossref] [PubMed]
- Harris JR, Lueg E, Genden E, et al. The thoracoacromial/cephalic vascular system for microvascular anastomoses in the vessel-depleted neck. Arch Otolaryngol Head Neck Surg 2002;128:319-23. [Crossref] [PubMed]
- Aycock JK, Stenson KM, Gottlieb LJ. The thoracoacromial trunk: alternative recipient vessels in reoperative head and neck reconstructive microsurgery. Plast Reconstr Surg 2008;121:88-94. [Crossref] [PubMed]
- Rosko AJ, Ryan JT, Wizauer EJ, et al. Dorsal scapular artery as a recipient vessel in the vessel-depleted neck during free tissue transfer in head and neck reconstruction. Head Neck 2017;39:E72-6. [Crossref] [PubMed]
- Ikka L, Mihalea C, Achour NB, et al. The origin of the dorsal scapular artery: anatomic variations and surgical applications. Surg Radiol Anat 2016;38:1021-7. [Crossref] [PubMed]
- Loukas M, du Plessis M, Owens DG, et al. The lateral thoracic artery revisited. Surg Radiol Anat 2014;36:543-9. [Crossref] [PubMed]
- Salgarello M, Snider F, Finocchi V, et al. The Pruitt-Inahara carotid shunt as an assisting tool to anastomose the arterial free flap pedicle to the internal carotid artery in the vessel-depleted neck. Microsurgery 2011;31:234-6. [Crossref] [PubMed]
- Lee HS, Park SY, Jang HJ, et al. Free jejunal graft for esophageal reconstruction using end-to-side vascular anastomosis and extended pharyngo-jejunostomy. Ann Thorac Surg 2012;93:1850-4. [Crossref] [PubMed]
- Nelson JA, Fischer JP, Grover R, et al. Vein grafting your way out of trouble: Examining the utility and efficacy of vein grafts in microsurgery. J Plast Reconstr Aesthet Surg 2015;68:830-6. [Crossref] [PubMed]
- Vasilakis V, Patel HD, Chen HC. Head and neck reconstruction using cephalic vein transposition in the vessel-depleted neck. Microsurgery 2009;29:598-602. [Crossref] [PubMed]
- Horng SY, Chen MT. Reversed cephalic vein: a lifeboat in head and neck free-flap reconstruction. Plast Reconstr Surg 1993;92:752-3. [Crossref] [PubMed]
- Ethunandan M, Cole R, Flood TR. Corlett loop for microvascular reconstruction in a neck depleted of vessels. Br J Oral Maxillofac Surg 2007;45:493-5. [Crossref] [PubMed]
- Lin CH, Mardini S, Lin YT, et al. Sixty-five clinical cases of free tissue transfer using long arteriovenous fistulas or vein grafts. J Trauma 2004;56:1107-17. [Crossref] [PubMed]
- Ciudad P, Agko M, Date S, et al. The radial forearm free flap as a "vascular bridge" for secondary microsurgical head and neck reconstruction in a vessel-depleted neck. Microsurgery 2018;38:651-8. [Crossref] [PubMed]

马牧之
上海交通大学医学院附属第九人民医院口腔种植科规范化培训住院医师,香港大学牙医学院荣誉研究助理,国际牙科研究协会(IADR)会员。曾于香港大学牙医学院硕博连读并取得口腔颌面外科博士学位。主持香港研究资助委员会种子基金计划(Hong Kong Research Grants Council Seed Fund Project)1项,国家级大学生创新创业训练计划创新训练项目1项,浙江省大学生科技创新活动计划(新苗人才计划)项目2项。能够独立开展颌骨囊肿和三大腺体的手术,对于常规的口腔颌面部肿瘤颅颌联合根治技术、皮瓣移植术及显微修复重建外科有一定的熟悉和了解。(更新日期:2022-04-28)

陈正岗
青岛市市立医院口腔颌面外科。主任医师、教授、硕士研究生导师、山东大学口腔颌面外科学博士、瑞典哥德堡大学联合培养医学博士、上海交通大学医学院附属第九人民医院口腔颌面外科学博士后、韩国延世大学附属Severance口腔医院访问学者、山东大学齐鲁医学院项目副研究员。青岛市拔尖人才、青岛市医疗卫生优秀学科带头人。主要研究方向是口腔颌面恶性肿瘤的整复及分子机制。主持国家自然科学基金面上项目1项、中国博士后科学基金面上资助项目1项、省市级课题7项。以第一作者或通讯作者发表SCI论文5篇,中文核心期刊论文40余篇。(更新日期:2022-04-28)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Prince ADP, Broderick MT, Heft Neal ME, Spector ME. Head and neck reconstruction in the vessel depleted neck. Front Oral Maxillofac Med 2020;2:13.